
【题目】化学兴趣小组的同学进行了以下实验:向烧杯中加入变质的氢氧化钙固体和一定量的稀盐酸,一段时间后固体全部溶解。他们对所得溶液中的溶质成分进行了探究。
Ⅰ.探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:______________; 猜想二:CaCl2和HCl;
猜想三: CaCl2、Ca(OH)2; 猜想四: CaCl2、Ca(OH)2和HCl;
根据所学知识判断,_________一定不成立。
【查阅资料】氯化钙溶液呈中性,碳酸钠溶液呈碱性。
【进行实验】
实验步骤:取少量烧杯内溶液加入试管中,滴入几滴酚酞溶液,振荡。
实验现象1:_________。结论:猜想三不成立。
实验步骤:取少量烧杯内溶液加入另一支试管中,逐滴加入碳酸钠溶液至过量。
实验现象2:_________。结论:猜想一不成立,猜想二成立。
【反思与拓展】
酸性较强的液体直接进入下水道,会污染环境。要处理上述烧杯内的溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的_________。
A.CaO B.CaCO3 C.Ca(OH)2
(2)氢氧化钠在空气中变质的化学方程式_________________。
Ⅱ.取50g含CaCl2和HCl的混合溶液,向其中逐滴滴入溶质质量分数为5.3%的碳酸钠溶液,同时充分搅拌。测得生成的气体和沉淀的质量与加入的碳酸钠溶液的质量关系如下图所示。

(1)由图可知,当碳酸钠溶液质量加到_________g时,溶液中盐酸恰好反应完。
(2)原烧杯溶液中氯化钙的质量分数______。(请写出计算过程)
【答案】 CaCl2 猜想四 不变红色 先产生气泡后生成沉淀 B CO2+2NaOH=Na2CO3+H2O 20 4.44%
【解析】氢氧化钙固体和稀盐酸生成氯化钙和水,所以反应后溶液中一定有氯化钙,还可能由过量的反应物,刚好完全反应时,只有溶质氯化钙;氢氧化钙溶液显碱性,能使酚酞试液变红,所以:取少量烧杯内溶液加入试管中,滴入几滴酚酞溶液,振荡,溶液不变色,可说明,反应后的溶液中无氢氧化钙。由于碳酸钙能与盐酸反应,所以,向CaCl2和HCl的混合溶液中滴加碳酸钠时,先和盐酸反应,因生成二氧化碳而冒气泡,盐酸反应完,再与氯化钙反应生产碳酸钙白色沉淀;将CaCl2和HCl中的氯化氢除掉,溶质只有氯化钙的方法可以向烧杯中加入过量的碳酸钙,因为碳酸钙和盐酸反应生成氯化钙、二氧化碳、水,不引入杂质;(2)氢氧化钠在空气中变质,是氢氧化钠和二氧化碳生成碳酸钠和水,化学方程式为:CO2+2NaOH=Na2CO3+H2O ;(1)由图可知,当碳酸钠溶液质量加到20g时,溶液中盐酸恰好反应完。(2)由图可知,和氯化钙反应的碳酸钠溶液为60g-20g=40g,设原烧杯溶液中氯化钙的质量为x 则
CaCl2 + Na2CO3=CaCO3↓+2NaCl,
111 106
x 40g×5.3%
111/x= 106/40g×5.3% x=2.22g
原烧杯溶液中氯化钙的质量分数=2.22g÷50g×100%= 4.44%
答:略


科目:初中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的食品和饲料添加剂,某补血剂样品【主要成分为硫酸亚铁晶体(FeSO4xH2O)】,某化学兴趣小组对其产生了兴趣并进行了探究:
【探究一】硫酸亚铁晶体(FeSO4xH2O)热分解研究
【查阅资料】
1.无水硫酸铜粉末遇水会变成蓝色的硫酸铜晶体;
2.硫酸亚铁晶体加热时,先失去结晶水,高温会继续分解产生金属氧化物和气态非金属氧化物。
3.二氧化硫能使高锰酸钾溶液褪色。
【进行实验】该兴趣小组同学称取27.8g硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行分析,并利用SDTQ600热分析仪,对硫酸亚铁晶体热分解获得相关数据,绘制成图2所示的关系图,试回答:
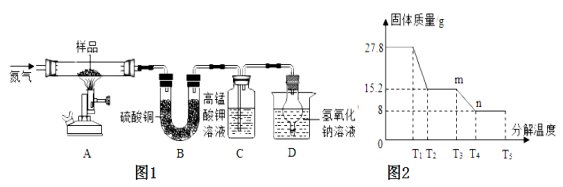
(1)装置B中硫酸铜粉末变蓝,说明产物中有 ,该物质的质量是 g;装置C中高锰酸钾溶液褪色,说明产物中还有 ;硫酸亚铁晶体完全分解后,装置A中的固体呈红棕色,放入足量稀盐酸,固体全部溶解,且得到黄色溶液,则该红棕色固体与稀盐酸反应的化学方程式为 。
(2)D装置中球形干燥管的作用是 。
(3)硫酸亚铁分解生成铁的氧化物和硫的两种氧化物,请写出化学反应方程式 。
(4)根据图2中的数据,请求出FeSO4xH2O中的x= 。(不写过程)
【交流讨论】实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
【探究二】补血剂样品中硫酸亚铁的含量:
①取10g补血剂样品研细后溶于40g水中,研细的目的是 ;
②向所配制的溶液中加氯化钡溶液至略过量,使其充分反应;
③过滤,洗涤,干燥,称量所得白色固体的质量为6.99g。
请计算出10g样品中FeSO4的质量分数,写出计算过程。此题2分。
(已知:FeSO4+BaCl2=BaSO4↓+FeCl2,有关相对分子质量:FeSO4—152,BaSO4—233)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属是人类生活中的常用的材料。
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是________。(填“符号”)
(2)铁钉在初中化学实验中多次出现,下图展示了光亮铁钉的一系列变化。
![]()
(ⅰ)变化②中,铁钉主要与空气中的________________发生反应。
(ⅱ)变化③中除去铁锈的化学方程式为______________________。
(ⅲ)如果用a、b分别代表光亮的铁钉和无锈铁钉,则它们的质量关系________
A、a<b B、a>b C、a=b D、无法比较
(3)为探究锌、铁、铜三种金属的活动性,以及他们和氢元素的位置关系,小明设计了如下实验,你认为不需要进行的实验是__________________ (填字母序号)。
A.将铁粉放入硫酸锌溶液中 B.将铁粉放入稀硫酸中
C.将铁粉放入硫酸铜溶液中 D.将铜片放入稀硫酸中
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素。图中部分物质略去)。

①无色气体A是________,溶液C中所含的阳离子是________,固体D中含有的物质是_____________。
②在蓝色溶液B中加入铁粉时,发生反应的化学方程式为_____________。
③已知铜锈样品的质量是10g,固体F的质量是3.2g,则铜锈中含Cu2(OH)2CO3的质量分数是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关二氧化碳的说法错误的是
A.二氧化碳易溶于水,所以二氧化碳气体不能用排水法收集
B.二氧化碳是能加快绿色植物光合作用,可用作温室气肥
C.液态二氧化碳用于灭火,利用了CO2不助燃、不可燃、密度大于空气的性质
D.干冰气化时要吸收大量的热,可用作制冷剂
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生活中常常会发生一些变化,下列变化属于化学变化的是 ( )
A. 樟脑球在衣柜中渐渐消失
B. 在晾干的咸菜表面出现白色晶体
C. 给电熨斗通电产生热能
D. 吃进的食物一段时间后被消化了
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在我们的日常生活中出现了“加碘食盐”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为 ( )
A.元素 B.单质 C.分子 D.氧化物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如右图所示,下列说法正确的是( )
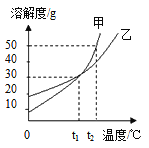
A. t1℃时,甲和乙的溶解度相等
B. 甲和乙的饱和溶液,从t1℃升温到t2℃,仍是饱和溶液
C. t2℃时,在100g水中放入60g甲,形成不饱和溶液
D. t1℃时,甲和乙各30g分别加入80g水中,均能完全溶解
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源,下列有关水的说法错误的是( )
A. 水通过三态变化,实现了自身的天然循环 B. 用滤纸过滤可以除去所有的杂质
C. 生活中可以用煮沸的方法降低水的硬度 D. 用肥皂水可以区分硬水与软水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com