
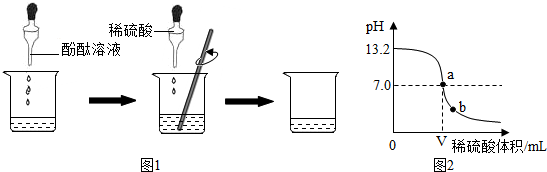
分析 (1)根据化学方程式的书写方法来分析;
(2)根据碱遇酚酞变红,利用酸碱反应使碱减少,颜色变化来分析;根据酸的性质来分析;
(3)用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH;据此进行分析判断.
(4)由图象信息分析回答.
解答 解:(1)硫酸与氢氧化钠反应的化学方程式为H2SO4+2NaOH═Na2SO4+2H2O,但是不能根据是否有水产生来判断反应的进行,因为原反应物的溶液中就含有水;故填:H2SO4+2NaOH═Na2SO4+2H2O;反应前酸碱溶液中含有水;
(2)方案一:因酚酞滴入到氢氧化钠溶液中变为红色,当向碱性溶液中加稀硫酸时,发生H2SO4+2NaOH═Na2SO4+2H2O反应使碱减少至消失,则红色逐渐变浅至消失,即可利用溶液颜色的变化来判断发生反应;故填:溶液由红色逐渐变浅直至无色;
方案二:稀盐酸能与碳酸钠溶液反应生成二氧化碳气体,故可用碳酸钠来进行检验;故填:碳酸钠溶液;没有气泡产生;
(3)用pH试纸测定溶液pH的方法为:用玻璃棒蘸取少许待测液滴在PH试纸上,然后把试纸显示的颜色与标准比色卡对照,即可确定溶液的酸碱度,切记不能直接把试纸浸入待测液中,也不能先用水将pH试纸润湿后测定,因为这样做会稀释待测液,使测量结果不准;故填:AC;
(4)根据图中曲线变化可判断氢氧化钠溶液与稀硫酸发生了化学反应,其依据是溶液的pH从大于7变为7.反应前氢氧化钠溶液的pH为13.2;当滴加的稀硫酸体积为VmL时,氢氧化钠溶液与稀硫酸恰好完全反应;b点溶液pH小于7,显酸性,硫酸过量,故含有的溶质是Na2SO4和H2SO4.故填:溶液的pH从大于7变为7;13.2;V;Na2SO4和H2SO4.
点评 本题属于实验探究习题,在探究碱的性质时学生应利用学过的碱的性质并结合习题中的信息来分析解答.


科目:初中化学 来源: 题型:解答题
| 元素 | Mg | Si | P | Cl | He | S |
| 物质或用途 | 镁光灯 | 水晶 | 磷酸盐矿 | 消毒液 | 充氦气的飞艇 | 青霉素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 请完成下列空格:
请完成下列空格:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 秋水仙碱中含氧元素的质量分数为24% | |
| B. | 秋水仙碱中碳、氢元素质量比为11:4 | |
| C. | 秋水仙碱由22个碳原子、25个氢原子、1个氮原子、6个氧原子构成 | |
| D. | 秋水仙碱中氢元素的质量分数最大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com