
【题目】我国科研人员在钠离子电池研究中又取得新突破。钠离子电池与锂离子电池工作原理相同、制造工艺相似,而且具有资源丰富、成本低廉、安全性能好等特点。一种钠离子电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解质溶液为的碳酸丙烯酯溶液。
回答下列问题:
(1)基态Na原子的电子排布式为__,最高能层电子云轮廓图形状为___。
(2)Te与S同主族,与![]() 同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。
同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。
(3)碳酸丙烯酯的结构简式为![]() ,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。
,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。
(4)C元素的最高价氧化物的电子式为___,CO32-的VSEPR模型名称是___,ClO4-的立体构型是__。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是__,该配离子包含的作用力为___(填选项字母)。
A.极性键 B.金属键 C.氢键 D.配位键
(6)由原料制备负极材料的反应过程中,是否有电子转移___(填“是”或者“否”)。
【答案】1s22s22p63s1 球形 p ![]() 1:13 sp2、sp3杂化
1:13 sp2、sp3杂化 ![]() 平面三角形 正四面体形 H2O AD 是
平面三角形 正四面体形 H2O AD 是
【解析】
(4)通过价层电子对互斥理论分析CO32-与ClO4-的电子对立体构型,结合中心原子有无孤电子对分析离子构型:价层电极对数=σ键电子对数+中心原子上的孤电子对数。据此进行分析。
(6)本问涉及复杂化合物的化合价的判断,复杂的化合物首先确定只有一种化合价的元素,然后再看有多种化合价但常用化合价只有一种的,最后结合化合物的化合价之和为零分析不常见的元素化合价,可以分析在Na2Co2TeO6中Na的化合价为+1价,O的化合价为-2价,结合Te和Co的可能变价以及化合物的化合价为零可知,Na2Co2TeO6中Co的化合价为+2价,Te的化合价为+6价,据此分析。
(1)基态Na原子核外电子数为11,其核外电子排布式为:1s22s22p63s1。最高能层为M层,只有1个s能级,其电子云轮廓图形状为球形。答案为:1s22s22p63s1;球形;
(2)Te与S同主族,与I同周期,说明Te的最外层排布同S一样,Te所具有的能层数与I相同,则可知Te属于元素周期表中p区元素,其基态原子的价电子排布图为:![]() ;答案为:p;
;答案为:p;![]() ;
;
(3)根据单键为σ键,双键中只有一个σ键,另一个为π键,结合碳酸丙烯酯的结构简式,可知其中π键有1个,σ键有13个,则其中π键和σ键的数目之比为1:13。碳酸丙烯酯中碳原子成键方式为单键和双键,成单键的碳原子形成4个σ键,没有孤电子对,杂化方式为sp3杂化,成双键的碳原子成3个σ键,没有孤电子对,杂化方式为sp2杂化,所以碳酸丙烯酯的碳原子轨道杂化方式为:sp2、sp3杂化。答案为:1:13;sp2、sp3杂化;
(4)C元素的最高价氧化物为CO2,其电子式为:![]() ;CO32-中碳原子价层电子对数=
;CO32-中碳原子价层电子对数=![]() ,且不含孤电子对,所以CO32-的VSEPR模型名称是平面三角形。ClO4-中Cl原子的价层电子对数=
,且不含孤电子对,所以CO32-的VSEPR模型名称是平面三角形。ClO4-中Cl原子的价层电子对数=![]() ,且不含孤电子对,所以其立体构型是正四面体形。答案为:
,且不含孤电子对,所以其立体构型是正四面体形。答案为:![]() ;平面三角形;正四面体形;
;平面三角形;正四面体形;
(5)[Co(H2O)6]3+的配体为H2O,该配离子包含的作用力为H-O极性键、配位键,故答案为:H2O;AD;
(6)Na2Co2TeO6中Co的化合价为+2价,Te的化合价为+6价,与反应物相比,存在化合价的升降变化,故由原料制备负极材料的反应过程中,有电子转移,答案为:是。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】能够表示燃烧热的是( )
A. 2H2(g)+O2(g)=2H2O(g);△H1
B. S(g)+O2(g)= SO2(g);△H2
C. C(s)+![]() O2(g)= CO(g);△H3
O2(g)= CO(g);△H3
D. H2(g)+Cl2(g) = 2HCl(g);△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.2.3g金属钠变为钠离子时失去的电子数目为0.1NA
B.标准状况下,18g水所占体积为22.4L
C.20℃ 1.01×105 Pa时,11.2L氢气所含的原子数目为NA
D.32g氧气所含的原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组同学设计如图实验装置(部分夹持仪器未画出)探究氨气的还原性并检验部分产物。
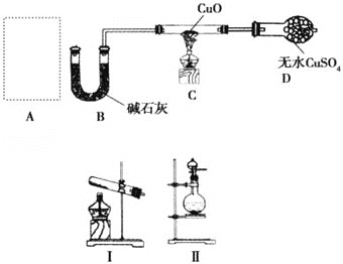
(1)若A中使用装置Ⅰ制取氨气,则化学方程式为__,发生装置试管口略向下倾斜的原因_____;若A中使用装置Ⅱ制取氨气,则分液漏斗中的试剂为__,圆底烧瓶中的固体可以为__。
(2)B中碱石灰的作用是__。
(3)氨气还原炽热氧化铜的化学方程式为__,装置C中的实验现象为__,装置D中的实验现象为__。
(4)①该装置存在明显的缺陷是__。
②请画出改进后需要增加连接的实验装置图________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )

A. a管发生吸氧腐蚀,b管发生析氢腐蚀
B. 一段时间后,a管液面高于b管液面
C. a处溶液的pH增大,b处溶液的pH减小
D. a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:P4(s,白磷)+5O2(g)=P4O10(s) ΔH=-2983.2 kJ·mol-1①
P(s,红磷)+![]() O2(g)=
O2(g)=![]() P4O10(s) ΔH=-738.5 kJ·mol-1②
P4O10(s) ΔH=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为_______。相同状况下,能量状态较低的是______;白磷的稳定性比红磷的_______(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)![]() 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.
A. ⑤⑥⑧B. ②⑤⑧C. ①③④D. ②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类比较早使用的金属之一。完成下列问题:
Ⅰ.电子工业中用30%的FeCl3 溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程如图所示。

(1)FeCl3 溶液蚀刻铜箔反应的离子方程式为:___________________________;
(2)滤液中存在较多的阳离子是____________________;
(3)以下试剂也可以替代氯气完成转化,最好选用的是________(填序号)。
a.酸性KMnO4溶液 b.溴水 c.H2O2 溶液
Ⅱ.某氯化铁样品中含有少量FeCl2杂质,现要测定其中铁元素的质量分数,实验步骤如下:
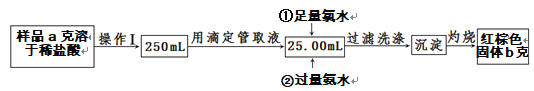
(4)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_________________________(填仪器名称)。
(5)写出②加入过量氨水的离子方程式:_____________________。
(6)样品中铁元素的质量分数为________________。
(7)若沉淀灼烧不充分,对最终测量结果的影响:________________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com