


科目:高中化学 来源: 题型:
| A、0.1mol |
| B、0.3 mol |
| C、0.5 mol |
| D、0.15 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化亚铁溶中通入氯气:Fe2++Cl2=Fe3++2Cl- |
| B、硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| C、氧化铜溶于硫酸:O2-+2H+=H2O |
| D、碳酸钙溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ |
| 备选装置 |  品红溶液 品红溶液 | 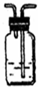 溴水 溴水 |  澄清石灰水 澄清石灰水 | 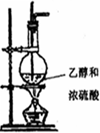 |
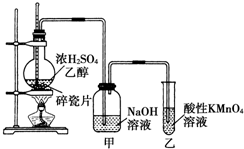
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲为AlCl3,乙为NaHCO3 |
| B、溶液丙中还可以大量共存的离子有:Fe2+、NO3-、SO42- |
| C、在甲中滴加丁开始反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D、白色沉淀A可能溶解在溶液D中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
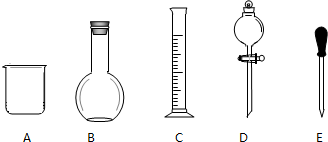 实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com