


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
| A、24g/mol |
| B、48g/mol |
| C、80g/mol |
| D、96g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学面对现代日益严重的环境问题显得无能为力 |
| B、实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 |
| C、摩尔是七个基本物理量之一 |
| D、化合物分为酸、碱、盐和氧化物是用树状分类法分类的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、②③⑤ |
| C、②⑤ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子浓度可能是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) |
| B、组成该溶液的溶质只能是Na2S或NaHS或二者的混合物 |
| C、离子物质的量的关系是2n(S2-)+n(HS-)+n(OH-)=n(Na+)+n(H+) |
| D、该溶液可能呈中性、碱性或酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
- 4 |
2- 3 |
2- 3 |
A、NH
| ||||||
B、NH
| ||||||
C、Ca2+、I-、MnO
| ||||||
D、Ca2+、CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
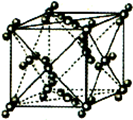 已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.
已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:
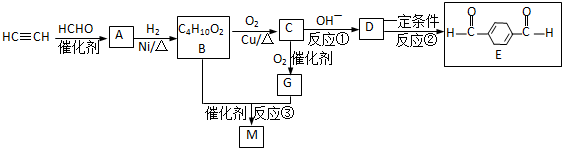
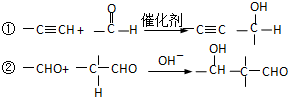
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com