


科目:高中化学 来源: 题型:
| A、X2和Y2 |
| B、YX2和Y2 |
| C、X2和XY |
| D、XY和Y2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
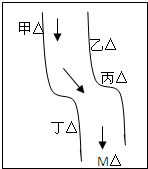 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:查看答案和解析>>
科目:高中化学 来源: 题型:
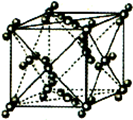 已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.
已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中滴入盐酸,生成无色气体,说明原溶液中一定有CO32- |
| B、某溶液中滴入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中一定有Cu2+ |
| C、某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中一定有SO42- |
| D、某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中一定有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 |
| B、1 mol?L-1 |
| C、3 mol?L-1 |
| D、1.5 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com