
【题目】锂离子电池是指以锂离子嵌入化合物为正极材料的电池。研究锂离子电池的电极材料、电解液具有重要的现实意义。
(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
①Li+能量最低的激发态的电子排布图为______________________。
②第四电离能I4(Co)比I4(Fe)小,原因是______________________。
(2)锂离子电池的电解液有LiBF4等,碳酸亚乙酯(![]() )用作该电解液的添加剂。
)用作该电解液的添加剂。
①LiBF4中阴离子的空间构型为____________________。
②碳酸亚乙酯分子中碳原子的杂化方式为___________________;碳酸亚乙酯能溶于水的原因是______________________________________________________。
(3)硫化锂是目前正在研发的锂离子电池的新型固体电解质,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
硫离子:(0,0,0);(![]() ),
),![]() ;
;![]() ;……
;……
锂离子:![]() ;
;![]() ;
;![]() ;
;![]() ;……
;……
①在图上画出硫化锂晶胞沿x轴投影的俯视图。___________
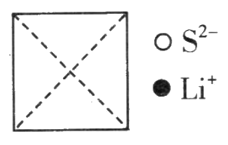
②硫离子的配位数为__________________。
③设NA为阿伏加德罗常数的值,硫化锂的晶体密度为________g·cm-3(列出计算表达式)。
【答案】![]() Co失去3d6上的一个电子,而Fe失去3d5上的一个电子,3d轨道半充满时稳定性强,故I4(Co)比I4(Fe)小 正四面体 sp3、sp2 碳酸亚乙酯分子与水分子之间形成氢键
Co失去3d6上的一个电子,而Fe失去3d5上的一个电子,3d轨道半充满时稳定性强,故I4(Co)比I4(Fe)小 正四面体 sp3、sp2 碳酸亚乙酯分子与水分子之间形成氢键  8
8 ![]()
【解析】
(1)①基态Li原子的核外电子排布图为![]() ,据此分析解答;
,据此分析解答;
②原子轨道中电子处于全满、全空或半满时较稳定,失去电子需要的能量更高;
(2)①根据VSEPR理论判断BF4-的空间构型;
②该分子中—CH2—中C原子价层电子对数是4且不含孤电子对、C=O中C原子价层电子对数是3且不含孤电子对,据此判断C原子杂化方式;碳酸亚乙酯分子与水分子之间形成氢键;
(3)①根据硫离子和锂离子的分数坐标分析判断绘图;
②从面心的S2-看,周围与之等距且最近的Li+有8个;
③根据ρ=![]() 计算晶体密度。
计算晶体密度。
(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
①基态Li原子的核外电子排布图为![]() ,基态Li+的核外电子排布图为
,基态Li+的核外电子排布图为![]() ,则Li+能量最低的激发态的电子排布图为
,则Li+能量最低的激发态的电子排布图为![]() ;
;
②Co3+价电子排布为3d6变为较稳定的3d5,而Fe3+价电子排布由较稳定的3d5变为不稳定的3d4,需要更多的能量,故第四电离能:I4(Co)<I4(Fe);
(2)①对于BF4,根据VSEPR理论,B原子的孤电子对数为![]() =0,σ键电子对数为4,则其空间构型为正四面体;
=0,σ键电子对数为4,则其空间构型为正四面体;
②该分子中—CH2—中C原子价层电子对数是4且不含孤电子对,—CH2—中碳原子为sp3杂化,C=O中C原子价层电子对数是3且不含孤电子对,C=O中C原子杂化方式为sp2;碳酸亚乙酯能溶于水的原因是碳酸亚乙酯分子与水分子之间形成氢键;
(3)①根据硫离子的坐标参数,硫离子位于晶胞的面心、顶点;根据锂离子的分数坐标参数,锂离子位于晶胞的内部,结合坐标位置,则硫化锂晶胞沿x轴投影的俯视图为: ;
;
②根据①中的分析,结合俯视图,从面心的S2看,周围与之等距且最近的Li+有8个,所以S2的配位数为8;
③1个晶胞中有S2的数目为8×![]() +6×
+6×![]() =4个,含有Li+数目为8个,晶胞参数为apm,一个晶胞体积为V=a3pm3=a3×1030cm3,1mol晶胞的体积为a3×1030NAcm3,1mol晶胞质量为m=4×46g,所以晶体密度为ρ=
=4个,含有Li+数目为8个,晶胞参数为apm,一个晶胞体积为V=a3pm3=a3×1030cm3,1mol晶胞的体积为a3×1030NAcm3,1mol晶胞质量为m=4×46g,所以晶体密度为ρ=![]() =
=![]() =
=![]() g/cm3。
g/cm3。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分:
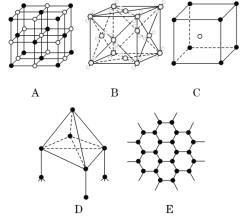
(1)代表金刚石的是(填编号字母,下同)____,其中每个碳原子与____个碳原子最接近且距离相等;
(2)代表石墨的是______,每个正六边形占有的碳原子数平均为____个;
(3)代表NaCl的是_______ ,代表CsCl的是_____,每个Cs+与____个Cl-紧邻。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )

A.简单离子半径:Z<Y
B.第一电离能:Y<X
C.m中存在离子键和极性键
D.W2Y2中含有非极性键,为极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的AOH和BOH两种碱的稀溶液,加水稀释至原体积的n倍。两溶液稀释倍数的对数值(lgn)与溶液的pH变化关系如图所示。下列叙述正确的是

A.水的电离程度:Z>X=Y
B.常温下,Kb(BOH)<Kb(AOH)
C.中和等体积X、Y两点溶液,后者消耗HC1的物质的量多
D.物质的量浓度相同的AC1溶液和BC1溶液,前者阳离子浓度之和小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为![]() ,试回答下列有关问题。
,试回答下列有关问题。
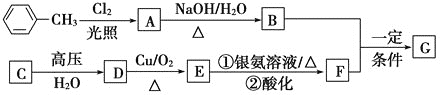
(1)G的结构简式为_________。
(2)指出下列反应的反应类型:A转化为B:________,C转化为D:__________。
(3)写出下列反应的化学方程式
D生成E的化学方程式:___________________。
A生成B的化学方程式:__________________。
(4)符合下列条件的G的同分异构体有________种。
a.苯环上有3个取代基,且有两个取代基相同;
b.能够与新制的银氨溶液反应产生光亮的银镜。
其中共有四种不同化学环境氢原子的同分异构体的结构简式为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A. CH4 C3H6 B. CH4 C2H4 C. C2H4 C3H4 D. C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下2.2gCO2中含有共用电子对的数目为2NA
B.18g D2O中含有的电子总数为10NA
C.在常温下,4.4g的CO2和N2O混合气体所含的原子数一定是0.3NA
D.1 mol Na2O2所含阴离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol/L的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。 请回答下列问题:
(1)滴定前,用移液管量取待测NaOH溶液于 _____中( 填仪器名称),并加入2~3滴指示剂;
(2)盛装标准盐酸的仪器名称为 _____ ;
(3)如何判断滴定终点(需写出颜色变化) __________ ;
某学生做了三组平行实验,数据记录如下:
(4)选取下述合理数据,算出待测NaOH溶液的物质的量浓度为 ___________;(保留四位有效数字)
实验序号 | 待测NaOH溶液的体积/ mL | 0.1000mol.L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
(5)下列哪些操作会使测定结果偏低____________。
a.反应容器用蒸馏水洗净后,未用待测液润洗
b.滴定前,平视读数;滴定后,仰视读数
c.滴定前,尖嘴无气泡;滴定后,尖嘴出现气泡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com