
【题目】如图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分:
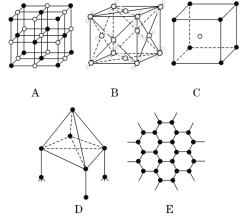
(1)代表金刚石的是(填编号字母,下同)____,其中每个碳原子与____个碳原子最接近且距离相等;
(2)代表石墨的是______,每个正六边形占有的碳原子数平均为____个;
(3)代表NaCl的是_______ ,代表CsCl的是_____,每个Cs+与____个Cl-紧邻。
【答案】D 4 E 2 A C 8
【解析】
根据晶体的组成微粒和结构特征分析判断。
A是阴、阳离子形成的离子晶体,A为面心立方结构,阴、阳离子的配位数都为6,A为NaCl;B是由分子形成的分子晶体,B为面心立方结构,B为干冰;C是阴、阳离子形成的离子晶体,C为体心立方结构,阴、阳离子的配位数都为8,C为CsCl;D是由原子间通过共价键形成的空间网状结构的原子晶体,每个原子形成4个共价键,D是金刚石;E是原子以共价键形成的平面层状结构,每个原子形成3个共价键,E为石墨;
(1)代表金刚石的是D;在金刚石中每个碳原子与紧邻的4个碳原子形成正四面体的结构单元;
(2)代表石墨的是E;在石墨中每个碳原子形成3个正六边形,每个正六边形占有的碳原子的平均个数为6×![]() =2;
=2;
(3)代表NaCl的是A;代表CsCl的是C,根据晶胞每个Cs+与8个Cl-紧邻。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于![]() 的说法错误的是
的说法错误的是
A.属于金属元素B.![]() 和
和![]() 是钇元素的两种同位素
是钇元素的两种同位素
C.原子的核外电子数为39D.质子数与中子数之差为50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是一种常用的消毒剂,易溶于水、易挥发、见光或受热易分解。其制备原理为:![]() △H<0,同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图。
△H<0,同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图。

(1)过氧乙酸保存时应注意______________(填标号)。
A.避光B.低温C.密闭D.隔绝空气
(2)仪器a的名称为______________,其中盛放的试剂为______________(填“乙酸”或“双氧水”)。
(3)为减少反应瓶中乙酸丁酯的损耗,反应开始前,在油水分离器中应进行的操作是______________。
(4)反应体系采用减压的目的是____。
(5)过氧乙酸(含有少量H2O2杂质)的含量测定流程如图。
![]()
①判断H2O2恰好除尽的实验现象是______________。
②过氧乙酸被Fe2+还原,还原产物之一为乙酸,其离子方程式为______________
③若样品体积为VomL,加入c1mol·L-1FeSO4溶液V1mL,消耗c2mol·L-1K2Cr2O7溶液V2mL。则过氧乙酸含量为______________g.L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有KMnO4溶液的试管中加入过量的MnSO4溶液,产生黑色沉淀,溶液由紫红色变为无色;过滤,向滤液中加入少量的铋酸钠(NaBiO3)粉末,溶液又变为紫红色。下列推断错误的是
A.氧化性:NaBiO3>KMnO4>MnO2
B.生成8.7g黑色沉淀,转移0.2mol电子
C.利用NaBiO3可以检验溶液中的Mn2+
D.NaBiO3可与浓盐酸发生反应:NaBiO3+6HC1=BiCl3+Cl2↑+NaCl+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质可溶于水、乙醇,熔点为209.5℃,其分子的结构简式如图,下列说法不正确的是( )
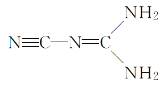
A.该分子与水分子可以形成氢键
B.该分子中原子最外层均达到8电子稳定结构的为C、N
C.1mol该物质中σ键和π键的个数比为5:3
D.该分子中C原子的杂化方式有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的共有几个( )
①NH3和H2O ②BF3和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥![]() 和
和![]() ⑦NF3和Al2Cl6
⑦NF3和Al2Cl6
A.6B.5C.4D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是指以锂离子嵌入化合物为正极材料的电池。研究锂离子电池的电极材料、电解液具有重要的现实意义。
(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
①Li+能量最低的激发态的电子排布图为______________________。
②第四电离能I4(Co)比I4(Fe)小,原因是______________________。
(2)锂离子电池的电解液有LiBF4等,碳酸亚乙酯(![]() )用作该电解液的添加剂。
)用作该电解液的添加剂。
①LiBF4中阴离子的空间构型为____________________。
②碳酸亚乙酯分子中碳原子的杂化方式为___________________;碳酸亚乙酯能溶于水的原因是______________________________________________________。
(3)硫化锂是目前正在研发的锂离子电池的新型固体电解质,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
硫离子:(0,0,0);(![]() ),
),![]() ;
;![]() ;……
;……
锂离子:![]() ;
;![]() ;
;![]() ;
;![]() ;……
;……
①在图上画出硫化锂晶胞沿x轴投影的俯视图。___________
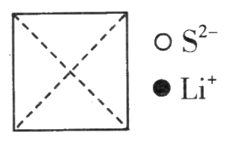
②硫离子的配位数为__________________。
③设NA为阿伏加德罗常数的值,硫化锂的晶体密度为________g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学用下图装置制备并探究K2FeO4的性质。制备原理:3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,装置如图所示(夹持装置略)。
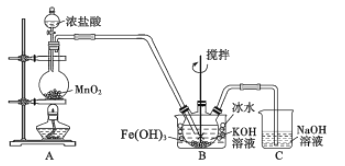
(1)盛放二氧化锰的仪器名称___________________,装置C的作用是____________________。
(2)装置A 中反应的化学方程式是________________________________________。
(3)实验时采用冰水浴的原因是________________,此装置存在一处明显缺陷,请指出___________。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是_________。
(5)查阅资料知,K2FeO4能将 Mn2+氧化成 MnO4-。该小组设计如下实验进行验证:
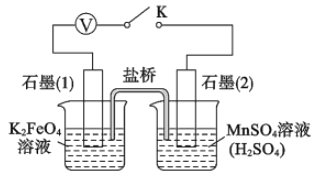
关闭K,左烧杯溶液变黄色,右烧杯溶液变紫色。检验左侧烧杯溶液呈黄色的原因,需要的试剂是_______;写出上图中负极的电极反应式: _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com