


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
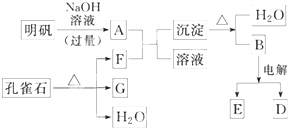 在一定条件下可实现如图所示物质之间的变化:
在一定条件下可实现如图所示物质之间的变化:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| C | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀说明溶液X中一定含有SO42- |
| B、取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C、粗略配制浓度为2mol?L-1的NaCl溶液,可将58.5g NaCl加入到盛有500mL水的烧杯中,搅拌、溶解 |
| D、对某固体进行焰色反应实验,火焰呈黄色,说明该物质为一定钠盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
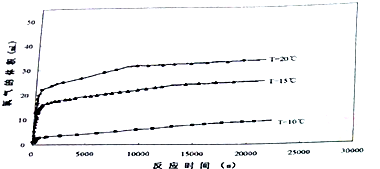 新型绿色硝化剂N205较传统硝化剂具有反应热效应小、温度容易控制、产物分离简单等优点,因而得到广泛的应用.
新型绿色硝化剂N205较传统硝化剂具有反应热效应小、温度容易控制、产物分离简单等优点,因而得到广泛的应用.| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol.L-1 | 4.00 | 3.52 | 2.00 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
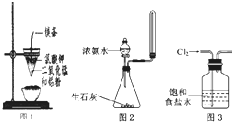
| A、图1装置可制得金属锰,用同样的装置可制得金属铬 |
| B、实验室用图2所示装置制取少量纯净的氨气 |
| C、用玻璃棒蘸取某溶液做焰色反应实验,火焰呈黄色不能说明该溶液中含有钠元素 |
| D、实验室用图3所示装置除去Cl2中的少量HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com