
| A、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
| B、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C、将氯化钠固体放入容量瓶中,然后加水稀释制取氯化钠溶液 |
| D、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
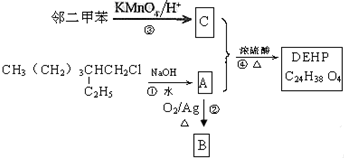
查看答案和解析>>
科目:高中化学 来源: 题型:
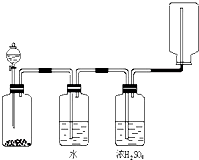
 W、X、Y、Z为四种短周期主族元素,其位置关系如图.
W、X、Y、Z为四种短周期主族元素,其位置关系如图. | W | X |
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1mol/L的醋酸溶液比0.01mol/L的醋酸溶液的K值小 |
| B、25℃时,甲基橙滴入0.1mol/L的醋酸溶液中,溶液呈黄色 |
| C、新制氯水与碳酸氢钠不反应 |
| D、等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH:pH(Na2CO3)>pH(NaClO)>pH(CH3COONa) |
查看答案和解析>>
科目:高中化学 来源: 题型:
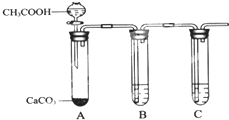
| A、锌和盐酸生成氢气 |
| B、亚硫酸钠和浓硫酸生成二氧化硫 |
| C、碳酸钙和盐酸生成二氧化碳 |
| D、氯化钠和浓硫酸生成氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com