
| A、碘单质 | B、碘酸钾 |
| C、碘化钾 | D、碘化银 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
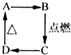 在如图中A,B,C,D分别代表有关反应中的一种化合物,其中物质A是现代光学及光纤制品的基本材料,它不溶于H2SO4、HNO3,却溶于氢氟酸,C为无色无味的气体,能使石灰水变浑浊,D为一种酸,请填写以下空白.
在如图中A,B,C,D分别代表有关反应中的一种化合物,其中物质A是现代光学及光纤制品的基本材料,它不溶于H2SO4、HNO3,却溶于氢氟酸,C为无色无味的气体,能使石灰水变浑浊,D为一种酸,请填写以下空白.查看答案和解析>>
科目:高中化学 来源: 题型:
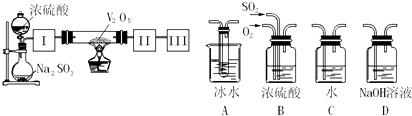
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(a+5.1)克 |
| B、(a+1.02)克 |
| C、(a+20.4)克 |
| D、(a+2.04)克 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定有KNO3和Na2CO3,没有Ba(NO3)2 |
| B、肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 |
| C、肯定没有Na2CO3和Ba(NO3)2,可能有KNO3 |
| D、以上判断都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、①②③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为QkJ |
| C、将反应的温度由T1升高至T2,则反应的平衡常数K1>K2 |
| D、当反应吸收热量为0.25QkJ时,生成的HCl恰好与1 molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com