
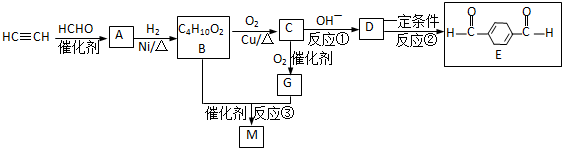
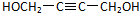 ,该反应属于加成反应;A分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M:
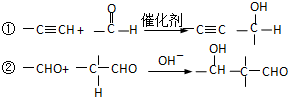
,该反应属于加成反应;A分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M: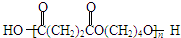 ;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E,根据化合物E的结构简式中含有的C、H、O原子个数,可得其分子式为C8H8O2;
;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E,根据化合物E的结构简式中含有的C、H、O原子个数,可得其分子式为C8H8O2;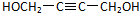 ,A分子中含有碳碳三键,能够与氢气发生加成反应生成有机物BHOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M:
,A分子中含有碳碳三键,能够与氢气发生加成反应生成有机物BHOCH2CH2CH2CH2OH,B催化氧化生成C,C还能够催化氧化生成G,则C为醛:OHC-CH2-CH2-CHO,G分子中含有两个羧基:HOOCCH2CH2COOH;B和G能够发生③酯化反应生成聚酯M: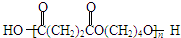 ;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E
;2分子C在OH-条件下发生加成反应,生成对称的六元环状物D,D中含有2个醛基、2个醇羟基,且醇羟基连在环上的碳原子与醛基连在环上的碳原子相邻;D中环上醇羟基在一定条件下可以发生消去反应,则1分子D失去2分子水,生成1分子E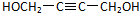 ;
;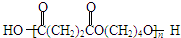 ,
,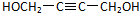 ;
;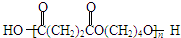 ;
;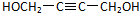 分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成醛C:OHC-CH2-CH2-CHO,则B生成C的化学方程式为:
分子中含有碳碳三键,与氢气发生加成反应生成有机物B:HOCH2CH2CH2CH2OH,B催化氧化生成醛C:OHC-CH2-CH2-CHO,则B生成C的化学方程式为: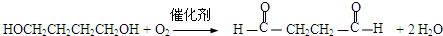 ,
,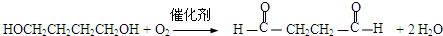 ;
;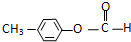 ,
, .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 相关信息 |
| X | 它的一种核素的原子核内没有中子 |
| Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z | 基态原子的最外层电子排布式为nsnnpn+1 |
| W | 与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T | 主要化合价有+1和+2价,且[T(X2W)4]2+均呈蓝色 |
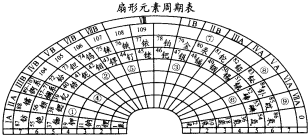
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
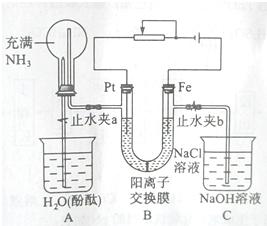
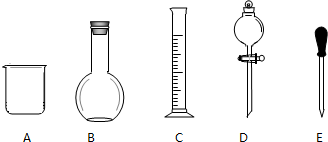 实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清的石灰水加入烧杯中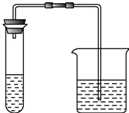 | 清的石灰水变浑浊 | 证明含有碳酸根离子 |
| Ⅱ.取第二份溶液,先别滴加 后加 | 证明含有硫酸根离子 | |
| Ⅲ.取第三份溶液加入过量BaCl2溶液,过滤,除去SO4-和CO32-,再滴加AgNO3溶液和稀硝酸 | 有 | 证明含有氯离子 |
| Ⅳ.取第四份溶液进行焰色反应 | 透过蓝色钴玻璃 火焰呈 | 证明含有K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B、原溶液中一定不含有HCO3-或CO32- |
| C、原溶液中一定含有Ba2+、Al3+ |
| D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com