
| A、4 | B、>4 | C、<4 | D、无法判断 |
| 10 |
| 1000 |
| 10 |
| 1000 |


科目:高中化学 来源: 题型:
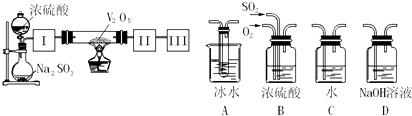
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、①②③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水 |
| B、AgNO3 |
| C、NaOH |
| D、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了使所配溶液浓度均匀,定容结束后,手握瓶颈左右振荡 |
| B、用蒸馏水洗后必须要将容量瓶烘干 |
| C、为了操作简便,浓溶液稀释可直接在容量瓶中进行 |
| D、使用前要检查容量瓶是否漏液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为QkJ |
| C、将反应的温度由T1升高至T2,则反应的平衡常数K1>K2 |
| D、当反应吸收热量为0.25QkJ时,生成的HCl恰好与1 molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度为0.1 mol?L-1 |
| B、物质的量浓度为1 mol?L-1 |
| C、含NaOH 4 g |
| D、含NaOH 0.1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com