
| ||
| ||


科目:高中化学 来源: 题型:
| A、甲的分子数比乙的分子数多 |
| B、甲的体积比乙大 |
| C、两气体的气体摩尔体积相同 |
| D、甲的相对分子质量比乙的相对分子质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | 固体物质中有FeCl3 | |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含 |
查看答案和解析>>
科目:高中化学 来源: 题型:
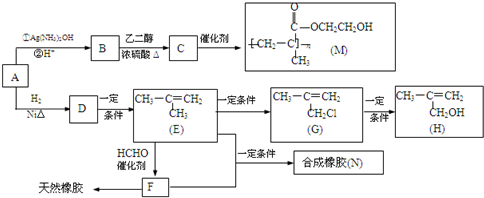
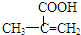 ,该不饱和酸有多种同分异构体,请写出属于酯类且含有碳碳双键的同分异构体的结构简式
,该不饱和酸有多种同分异构体,请写出属于酯类且含有碳碳双键的同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
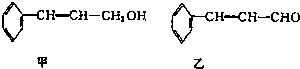
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl2褪色能在稀硫酸中水解 |
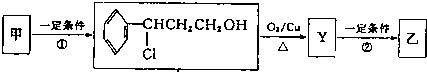
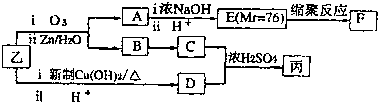
| ⅰO2 |
| ⅱZn/H2O |
| ⅰ浓NaOH |
| ⅱH+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
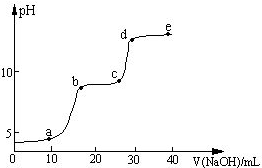 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.| 较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中可能存在Al3+ |
| B、溶液中可能存在Br- |
| C、溶液中一定存在CO32- |
| D、溶液可能存在Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com