
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
【答案】B
【解析】
先通入氨气再通入二氧化碳反应得到碳酸氢钠晶体和母液为氯化铵溶液,沉淀池中得到碳酸氢钠晶体,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,过滤得到碳酸氢钠晶体煅烧炉中加热分解,碳酸氢钠受热分解生成碳酸钠纯碱,过滤后的母液通入氨气加入细小食盐颗粒,冷却析出副产品氯化铵,氯化钠溶液循环使用, 据此分析。
A.向母液中通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出,选项A错误;
B.向母液中通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,从母液中经过循环Ⅰ进入沉淀池的主要是Na2CO3、NH4Cl和氨水,选项B正确;
C.沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl→NH4Cl+NaHCO3↓,选项C错误;
D.循环Ⅰ是将未反应的氯化钠返回沉淀池中使原料氯化钠的利用率大大提升,循环Ⅱ的目的是生成的二氧化碳通入沉淀池继续反应生成碳酸氢钠,二氧化碳利用率大大提升,选项D错误;
答案选B。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)请画出上述元素h的原子结构示意图_______;元素h位于元素周期表的第_____区。
(2)e、g两种元素的气态氢化物中更稳定的是_______(写化学式);
(3)b2a2分子的电子式是________ ,该分子中存在的σ键与π键的个数比为_______。
(4)c、d两种元素中第一电离能较大的是_________(写元素符号)。
(5)f和g两种元素形成的化合物是______(填“离子化合物”“共价化合物”)。a2d分子是_________分子(填极性分子或者非极性分子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )
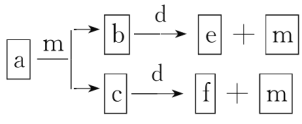
A.简单离子半径:Z<Y
B.第一电离能:Y<X
C.m中存在离子键和极性键
D.W2Y2中含有非极性键,为极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为![]() ,试回答下列有关问题。
,试回答下列有关问题。
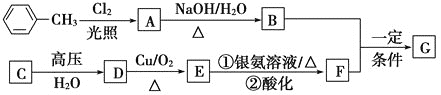
(1)G的结构简式为_________。
(2)指出下列反应的反应类型:A转化为B:________,C转化为D:__________。
(3)写出下列反应的化学方程式
D生成E的化学方程式:___________________。
A生成B的化学方程式:__________________。
(4)符合下列条件的G的同分异构体有________种。
a.苯环上有3个取代基,且有两个取代基相同;
b.能够与新制的银氨溶液反应产生光亮的银镜。
其中共有四种不同化学环境氢原子的同分异构体的结构简式为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A. CH4 C3H6 B. CH4 C2H4 C. C2H4 C3H4 D. C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置___,基态E2+价电子的排布图为___,B元素能量最高的电子其轨道呈__形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为__。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为___,B、C、D简单离子的半径由大到小的顺序为___。
(4)写出C的核外有18个电子的氢化物的电子式___。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO=E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___。
(6)已知沸点:B2H4>A2H6,主要原因为________。
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___
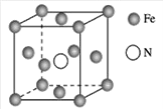
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下2.2gCO2中含有共用电子对的数目为2NA
B.18g D2O中含有的电子总数为10NA
C.在常温下,4.4g的CO2和N2O混合气体所含的原子数一定是0.3NA
D.1 mol Na2O2所含阴离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是
A. NaHCO3:NaHCO3![]() HCO3-+ Na+
HCO3-+ Na+
B. NaHSO4:NaHSO4=Na+ +HSO4-
C. CH3COONH4:CH3COONH4=NH4++CH3COO-
D. Fe(OH)3:Fe(OH)3![]() Fe(OH)2++2OH-
Fe(OH)2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 W 在工业上常用作溶剂和香料,其合成方法如下:
![]()
下列说法正确的是
A.N、W 互为同系物B.M 的二氯代物有 8 种结构
C.N 不可能所有原子共平面D.M、N、W 均能发生加成和取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com