
分析 电解法精炼铜时,粗铜为阳极,精铜为阴极,电解质溶液为硫酸铜,阳极材料是粗铜,阳极上失电子变成离子进入溶液,Cu-2e-=Cu2+,比金属铜活泼的金属锌、铁、镍会先于金属铜失电子,阴极上是铜离子得电子的还原反应,根据电解原理来回答.
解答 解:①电解法精炼铜时,粗铜为阳极,精铜为阴极,电解质溶液为硫酸铜,阳极材料是粗铜,阳极上失电子变成离子进入溶液,电极反应式:Cu-2e-=Cu2+,
故答案为:粗铜;Cu-2e-=Cu2+;
②精铜为阴极,阴极上是铜离子得电子的还原反应,即Cu2++2e-=Cu,故答案为:纯铜;Cu2++2e-=Cu.
点评 本题考查学生电解精炼铜的工作原理,把握阳极、阴极材料及电极反应为解答的关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
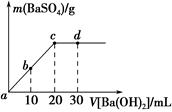 常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )| A. | 硫酸氢钠溶液的体积为10 mL | |
| B. | 溶液的导电能力:c<b<a | |
| C. | d时刻溶液的pH为13 | |
| D. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2KClO3 $\frac{\underline{MnO_2}}{△}$2KCl+3O2 | B. | 2HI+Cl2═2HCl+I2 | ||
| C. | CO2+C $\frac{\underline{\;高温\;}}{\;}$2CO | D. | 2HCl+CuO═CuCl2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mol•L-1 Na2SO4溶液中,粒子总数是0.83NA | |
| B. | 1 mol Fe3+完全水解,生成红氧化铁胶体位子的数目为NA | |
| C. | 常温常压下,16g O2和O3的混合气体中所含电子的数目为8NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有1.25mol NaN3被氧化 | B. | 被还原的N原子的数目是0.2NA | ||
| C. | 转移电子的物质的量为2mol | D. | 标准状况下生成44.8L N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com