
| A、新制氯水中加入固体NaOH:[Na+]=[Cl-]+[ClO-]+[OH-] |
| B、pH=8.3的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] |
| C、pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] |
| D、0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合:2[H+]-2[OH-]=[CH3COO-]-[CH3COOH] |


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
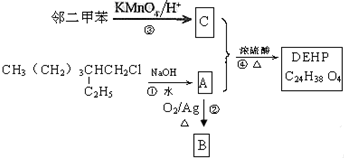
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3 溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH 溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2 溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
| 阴离子符号 | 物质的量浓度(mol?L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
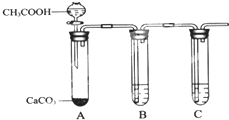 W、X、Y、Z为四种短周期主族元素,其位置关系如图.
W、X、Y、Z为四种短周期主族元素,其位置关系如图. | W | X |
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1mol/L的醋酸溶液比0.01mol/L的醋酸溶液的K值小 |
| B、25℃时,甲基橙滴入0.1mol/L的醋酸溶液中,溶液呈黄色 |
| C、新制氯水与碳酸氢钠不反应 |
| D、等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH:pH(Na2CO3)>pH(NaClO)>pH(CH3COONa) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com