
火力发电厂在发电过程中会释放大量的
SO2,CO,NO而造成污染,对燃煤烟气进行脱硫、脱碳、脱硝等处理,以实现绿色环保、废物利用的目的.
(1)脱硫.
①用采用活性炭吸附含SO2废气,2SO2+O2⇌2SO3
某研究小组研究燃煤烟气流速、温度、水蒸气含量等因素对SO2吸收效率的影响,实验结果如左图所示.
A 水蒸气含量10%,燃煤烟气流速0.01L/s
B 水蒸气含量5%,燃煤烟气流速0.01L/s
C水蒸气含量5%,燃煤烟气流速0.025L/s
根据左图所示,要提高燃煤烟气中SO2的吸收效率,烟气流速应选择 L/s,温度应选择 (填“高温”或“低温”),应该 水蒸气含量(填“提高”或“降低”)
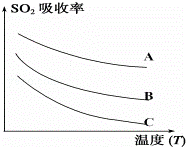
②用惰性电极电解SO2水溶液:H2SO3 O2↑+S↓+H2O
O2↑+S↓+H2O
装置如右图所示,S单质将在 极得到(填“a”或“b”)
该电极的电极反应式
不考虑溶液体积的变化,电解槽右池的pH将
(填“上升”、“降低”或“不变”)
| 物质 | CO | H2O | HCOOH |
| 浓度/mol•L﹣1 | 0.5 | 1.5 | 0.5 |
(2)脱碳.将CO转化为甲酸HCOOH的反应为CO(g)+H2O(g)⇌HCOOH (g),某温度下的平衡常数为1.5.此温度下,密闭容器中加入CO(g)与H2O(g),某时刻测得各组分的浓度如右表:
反应的平衡常数表达式 K= ;比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”).到达平衡时H2O的平衡转化率为 .
(3)脱硝.①烟气联合脱硝脱硫,可以有效提高可以显著提高SO2吸收效率,其主要原因在于NO对2SO2+O2⇌2SO3起催化作用,试用化学方程式表示该过程(提示:催化剂参与反应,但是质量和化学性质在反应前后都没有改变) 、 (不必配平)
②可以利用烟气中CO作为还原剂,催化还原NO,同步脱硝脱碳,
CO(g)+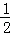 O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1;N2(g)+O2(g)=2NO(g)△H=182.6kJ•mol﹣1
O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1;N2(g)+O2(g)=2NO(g)△H=182.6kJ•mol﹣1
NO与CO反应得到无污染产物的热化学方程式为 .
考点:
化学平衡的影响因素;热化学方程式;化学平衡建立的过程;化学平衡常数的含义.
专题:
基本概念与基本理论.
分析:
(1)①从图象分析,烟速流量越大,二氧化硫吸收率越低,温度越高,吸收率越低,水蒸气含量越大,吸收率越高,据此分析;
②依据电池反应阳极上是氢氧根离子失电子生成氧气的反应,b为阳极,a为阴极,亚硫酸在阴极被还原为硫单质;用总反应方程式减去阳极反应式可得阴极反应式;
(2)化学平衡常数表达式K= ,不列入固态和纯液体物质;Qc<K时反应正向进行,反之逆向进行;平衡转化率利用三段式法计算;
,不列入固态和纯液体物质;Qc<K时反应正向进行,反之逆向进行;平衡转化率利用三段式法计算;
(3)①NO做催化剂参与反应,首先被氧化为NO2,NO2在氧化SO2成SO3;
②利用盖斯定律解答.
解答:
解:(1)①从图象分析,烟速流量越大,二氧化硫吸收率越低,温度越高,吸收率越低,水蒸气含量越大,吸收率越高,所以选择:烟速流量小、温度低、水蒸气含量高的环境,故答案为:0.01;低温;提高;
②依据电池反应阳极上是氢氧根离子失电子生成氧气的反应,电极反应式为:4OH﹣﹣4e﹣=2H2O+O2↑b为阳极,a为阴极,亚硫酸在阴极被还原为硫单质;用总反应方程式减去阳极反应式可得阴极反应式为:4e﹣+H2O+H2SO3=S↓+4OH﹣,右池pH升高,故答案为:a;4e﹣+H2O+H2SO3=S↓+4OH﹣;上升;
(2)反应CO(g)+H2O(g)⇌HCOOH (g)的平衡常数表达式为K= ;
;
Qc=0.50.5×1.5=0.67<K=1.5,反应正向进行,v(正)>v(逆);
CO(g)+H2O(g)⇌HCOOH (g)
反应前(mol/L) 0.5 1.5 0.5
反应了(mol/L) x x x
平衡后(mol/L)0.5﹣x 1.5﹣x 0.5+x
K= =1.5,解得:x=0.25mol/L,加入水蒸气的浓度为:(1.5+0.5)mol/L=2.0mol/L,反应的水蒸气浓度为:0.25mol/L+0.5mol/L=0.75mol/L,所以水蒸气的平衡转化率为:
=1.5,解得:x=0.25mol/L,加入水蒸气的浓度为:(1.5+0.5)mol/L=2.0mol/L,反应的水蒸气浓度为:0.25mol/L+0.5mol/L=0.75mol/L,所以水蒸气的平衡转化率为: =37.5%,
=37.5%,
故答案为:K= ;v(正)>v(逆);37.5%;
;v(正)>v(逆);37.5%;
(3)①NO做催化剂参与反应,首先被氧化为NO2,NO2在氧化SO2成SO3,化学方程式为2NO+O2=2NO2,NO2+SO2=SO3+NO,
故答案为:2NO+O2=2NO2;NO2+SO2=SO3+NO;
②已知①CO(g)+ O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1;②N2(g)+O2(g)=2NO(g)△H=182.6kJ•mol﹣1
O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1;②N2(g)+O2(g)=2NO(g)△H=182.6kJ•mol﹣1
据盖斯定律,①×2﹣②得:2CO(g)+2NO(g)=N2(g)+2CO2(g)△=﹣748.6KJ/mol,
故答案为:2CO(g)+2NO(g)=N2(g)+2CO2(g)△=﹣748.6KJ/mol.
点评:
本题考查了影响化学平衡移动的条件、电解原理、化学平衡常数及浓度熵、热化学方程式书写,考查全面,有一定难度.


科目:高中化学 来源: 题型:
实验目的:为研究铁质材料与热浓硫酸的反应
(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,应选择加入的试剂为 (选填序号)
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。据此推知气体Y 中SO2的体积分数为 。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(2)气体Y中 还有H2的原因是 。
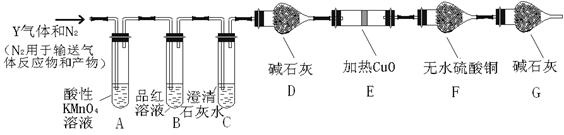
(3)装置A中试剂的作用是 ,反应的离子方程式 。
(4)简述确认气体Y中含有CO2的实验现象 。
(5)如果气体Y中含有H2,预计实验现象应是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的是某原子晶体A空间结构的一个单元,A与某物质B反应生成C,其实质是每个A﹣A键中插入一个B原子,则C物质的化学式为( )

|
| A. | AB | B. | AB4 | C. | AB2 | D. | A2B5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于pH的说法正确的( )
|
| A. | 强酸溶液的pH值一定比弱酸溶液小 |
|
| B. | pH值等于7的溶液,一定是中性的溶液 |
|
| C. | 常温下,由水电离出的c(H+)=10﹣12mol/L,则溶液pH一定为12 |
|
| D. | 常温下,pH=10的氨水溶液中,OH﹣总浓度与由水电离出的OH﹣浓度之比为106 |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,现有三种酸,a盐酸、b乙酸、c硫酸的稀溶液,下列说法正确的是( )
|
| A. | 同浓度,pH由大到小:c>a>b |
|
| B. | 同浓度同体积,分别与氢氧化钠中和,所需的氢氧化钠的物质的量由大到小:c>a>b |
|
| C. | 同pH,物质的量浓度由大到小:b>a>c |
|
| D. | 同pH同体积,分别于少量且质量相同的Zn片反应,反应所需时间由长到短:b>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2 L的戊烷所含的分子0.5NA
B. 28 g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
D. 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
用括号中的试剂除去各组中的杂质,正确的是( )
A. 苯中的甲苯(溴水) B. 95.6%乙醇中的水(CaO)
C. 乙烷中的乙烯(酸性高锰酸钾) D. 溴苯中的溴(苯)
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的CO2气体通入500mL某NaOH溶液中,充分反应后,将溶液在低温进蒸发,得到不含结晶水的白色固体A.取三份质量不同的A样品分别与50mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系职下表所示:
| 组 别 | ① | ② | ③ |
| 盐酸体积(mL) | 50 | 50 | 50 |
| A的质量 (g) | 3.80 | 5.70 | 7.60 |
| 气体体积(mL) | 896 | 1344 | 1344 |
(1)上表中第 组数据加入的50mL盐酸的反应后有剩余,
(2)试推断:A的成份为
(3)盐酸的物质的量的浓度为 mol•L﹣1.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com