
科目: 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:实验题
某课外小组欲鉴定某硫酸钠样品中是否含有亚硫酸钠,设计方案如下:取少量固体配成溶液,往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色。

如果溶液紫色褪去,说明该样品中含有亚硫酸钠。
(1)用离子方程式表示该反应原理: 。
(2)图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,量筒中液体的体积是____________mL。图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填字母)________________。
A.等于amL B.等于(25-a)mL C.大于amL D.大于(25-a)mL
(3)该小组同学欲测定样品中亚硫酸钠的含量,操作步骤如下:
a.称取mg样品,用蒸馏水溶解并置于锥形瓶中
b.将V1mL C1mol/L的酸性KMnO4溶液(过量)倒入锥形瓶中振荡
c.用C2mol/L草酸钠(Na2C2O4)溶液滴定过量的KMnO4,至滴定终点时用去Na2C2O4溶液V2mL
①KMnO4溶液应装在_________式滴定管中,达到滴定终点时溶液颜色的变 化 。
化 。
②样品中Na2SO3的物质的量为 mol。(用含C1 、V1 、C2、 V2的代数式表示)。
(4)下列操作会导致测得的Na2SO3的物质的量偏高的是 (填字母,双选)。
A.未用Na2C2O4标准液润洗滴定管
B.滴定前仰视盛有Na2C2O4溶液的滴定管,滴定后俯视
C.滴定前滴定管尖嘴处有气泡,滴定后消失
D.滴定时摇动锥形瓶,瓶中的液滴溅出
查看答案和解析>>
科目: 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:填空题
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4—(绿色)、Cr2O72—(橙红色)、CrO42—(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:
(1)Cr3+与Al3+的化学性质相似,往Cr2(SO4)3溶液中滴入NaOH溶液直至过量,可观察到的现象是 。
(2)CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol•L﹣1的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示。
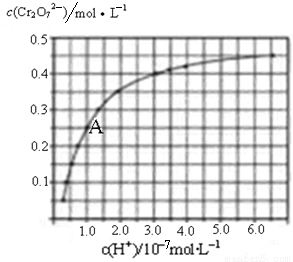
 ①用离子方程式表示Na2CrO4溶液中的转化反应 。
①用离子方程式表示Na2CrO4溶液中的转化反应 。
②由图可知,溶液酸性增强,CrO42﹣的平衡转化率 (填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
(3)用K2CrO4为指示剂,以AgNO3标准液滴定溶液中的Cl﹣,Ag+与CrO42﹣生成砖红色沉淀时到达滴定终点。当溶液中Cl﹣恰好完全沉淀(浓度等于1.0×10﹣5mol•L﹣1)时,溶液中c (Ag+)为 mol•L﹣1,此时溶液中c(CrO42﹣)等于 mol•L﹣1。(Ksp(Ag2CrO4)=2.0×10﹣12、Ksp(AgCl)=2.0×10﹣10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72﹣还原成Cr3+,反应的离子方程式为 。
查看答案和解析>>
科目: 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:填空题
(1)下列有关实验操作或结果的说法中正确的是 (填字母)。
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.滴定实验都需要指示剂
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
G.测定酸碱滴定曲线:开始时测试和记录的间隔可稍小些,滴定至终点附近则要大些
(2)NaHSO3溶液显 性,原因 (用化学用语和必要的文字说明),该溶液中离子浓度由大到小排序 。
(3)t℃时,水的离子积KW=1×10-13,pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(混合液体积变化忽略不计) 若所得混合液的pH=2,则a:b= 。
(4)已知PbI2的Ksp=7.0×10-9,将7.5×10-3mol/L的KI与一定浓度的Pb(NO3)2溶液按2∶1体积比混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为 (填序号)。
A.8.4×10-4 B.5.6×10-4 C.4.2×10-4 D.2.8×10-4
查看答案和解析>>
科目: 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)H﹣H、O = O和O﹣H键的键能分别为: a kJ/mol、b kJ/mol和c kJ/mol。CH3OH(g)的燃烧热为△H=—d kJ/mol。则CO2(g)+3H2(g) = CH3OH(g)+ H2O(l) △H= kJ•mol﹣1。(用含a、b、c、d的代数式表示)
(2)将CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的△H 0(填“>”或“<”)。若温度不变,减小反应投料比,K值将 (填“增大”、“减小”或“不变”)。

(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生反应制备二甲醚,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是 。(填字母,多选)
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
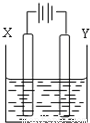
(4)以二甲醚、空气、KOH溶液组成的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,如图所示,请写出该燃料电池负极反应式 。当燃料电池消耗2.8LO2(标况)时,NaCl溶液的pH= (溶液体积变化忽略)(常温)。
查看答案和解析>>
科目: 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
分类是化学研究的重要方法,下列物质分类错误的是
A.化合物:干冰,明矾,烧碱,
B.同素异形体:C60,石墨,金刚石
C.非电解质:乙醇,四氯化碳,氯气
D.混合物:纯净矿泉水,盐酸,漂白粉
查看答案和解析>>
科目: 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
设阿伏伽德罗常数的数值,下列说法正确的是
A.含1molFeCl3溶液水解生成1molFe(OH)3胶体后生成NA个胶体粒子
B.分子数为NA的N2,CO混合气体体积为22.4L,质量为28g
C.0.5molFeBr2与足量氯气反应转移的电子数为NA
D.足量Zn与一定量的浓硫酸反应,产生22.4L标准状况气体时,转移的电子数为2NA
查看答案和解析>>
科目: 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
下列说法不正确的是①将BaSO4放入水中不能导电,所以硫酸钡是非电解质;
②氨溶于水得到的溶液氨水能导电,所以氨水是电解质;
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物可以导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A.①④ B.①④⑤ C.①②③④ D.①②③④⑤
查看答案和解析>>
科目: 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
下列离子方程式表达正确的是
A.Na2SO3溶液使酸性高锰酸钾溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O
B.铵明矾溶液中加入过量的氢氧化钡溶液:

C.向碳酸氢钙溶液中加入过量氢氧化钠溶液:
Ca2++2HCO3-+2OH-=BaCO3↓+CO32-十2H2O
D.弱酸尼泊金酸( )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应:
查看答案和解析>>
科目: 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
有10g Na2O2、Na2O、Na2CO3、NaOH的混合物与100g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为
A.11.7g B.5.85g C.8g D.15.5g
查看答案和解析>>
科目: 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
在下列物质的溶液中分别加入一定量Na2O2的固体,不会出现浑浊想象的是
A..饱和Na2CO3溶液 B.Ca(HCO3)2稀溶液 C.Na2SO3稀溶液 D.饱和FeCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com