
科目: 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应的离子方程式为3Fe2++2![]() +O2+4OH-===Fe3O4+
+O2+4OH-===Fe3O4+![]() +2H2O。下列说法正确的是()
+2H2O。下列说法正确的是()
A.O2和![]() 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B.参加反应的氧化剂与还原剂的物质的量之比为1∶5
C.每生成1mol![]() 转移2mol电子
转移2mol电子
D.每2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目: 来源: 题型:
【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。请回答下列问题:
(1)利用焰色反应可以定性鉴别某些金属盐。灼烧SrSO4时,锶的焰色为_____(填标号)。 A.洋红色 B.浅紫色 C.黄绿色 D.淡蓝色
(2)硫化锶(SrS)可用作发光涂料的原料,SrSO4和碳的混合粉末在隔绝空气下高温焙烧可生成硫化锶和一种还原性气体, 该反应的化学方程式____________________________。
(3)已知:25℃时,K sp(SrSO4)=3.2×10-7,K sp(SrCO3)=1.1×10-10。SrSO4的粉末与Na2CO3溶液混合加热、充分搅拌可生成硫酸钠和碳酸锶,若转化完成时恢复到25℃,混合液中c(CO![]() )=1.0×10-3mol/L,则c(SO
)=1.0×10-3mol/L,则c(SO![]() )=______________________。
)=______________________。
(4)以天青石生产Sr(OH)2·xH2O的工艺如下:

已知: Sr(OH)2 、Ca(OH)2在水中的溶解度如下表:
温度/(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①滤渣2为混有CaCO3的SrCO3,写出反应1生成SrCO3的化学方程式______________。
②固体3 “加热水浸”是为了获得较纯净的Sr(OH)2溶液/span>,此时应缓慢加热使沉淀颗粒长大,滤渣5的主要成分是______(填化学式),“趁热过滤”的目的是_________________________________。
③“操作6”主要有:________________、过滤、洗涤、干燥。
④取m g纯净Sr(OH)2·x H2O产品溶于水,加入过量Na2CO3溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=__________(用含m、n的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
A.氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2![]() =Mg2++2NH3H2O
=Mg2++2NH3H2O
B.沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
C.用食醋能清洗水垢:![]() +2CH3COOH=2CH3COO+H2O+CO2↑
+2CH3COOH=2CH3COO+H2O+CO2↑
D.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】H3BO3(一元弱酸)可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
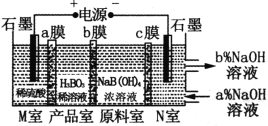
A.M室发生的电极反应式为:2H2O-4e-=O2↑+4H+
B.b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
C.理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
D.N室中:a%<b%
查看答案和解析>>
科目: 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
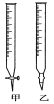
(2)本实验滴定达到终点的标志是___________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( )
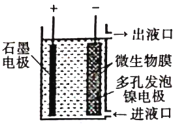
A. 若加人的是![]() 溶液,则导出的溶液呈碱性
溶液,则导出的溶液呈碱性
B. 镍电极上的电极反应式为:![]()
C. 电子由石墨电极流出,经溶液流向镍电极
D. 若阳极生成![]() 气体,理论上可除去
气体,理论上可除去![]() mol
mol![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据实验操作所得出的现象和结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成红色 | 原溶液中含有Fe2+ |
B | 将变黑的银器放入装满食盐水的铝盆中,二者直接接触 | 银器恢复往日光泽 | 2Al+3Ag2S+6H2O=6Ag+2Al(OH)3+3H2S↑ |
C | 向铬酸钾溶液中加入硫酸[已知:Cr2O72- (橙色)+H2O | 溶液由橙色变为黄色 | Cr2O72-转变为CrO42- |
D | 将石蜡油气化后,使气体流经碎瓷片,将生成的气体通入酸性高锰酸钾溶液 | 溶液紫红色褪去 | 碎瓷片的主要作用是使石蜡油受热均匀 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
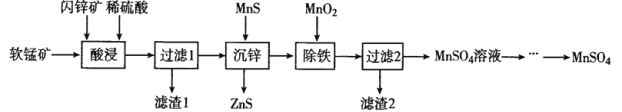
已知:常温下,Ksp(ZnS)=1.2×l0-24、Ksp(MnS)=1.5×10-15
关于该流程说法错误的是
A.“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是作催化剂。
B.“沉锌”反应为:Zn2+(aq)+MnS(s)![]() ZnS(s)+Mn2+(aq),该反应的平衡常数K为1.25×109
ZnS(s)+Mn2+(aq),该反应的平衡常数K为1.25×109
C.“除铁”时加二氧化锰是为了氧化Fe2+,然后向溶液加适量氨水将溶液pH调节为3~4
D.该流程中可以循环利用的物质是ZnS
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)某二价金属离子有9个价电子,价电子的能级为3d。该元素位于周期表中的第四周期、第______族。
(2)在氰酸钾(KOCN)的组成元素中,第一电离能最大的是______(填元素符号、下同)、电负性最小的是______;其中阴离子的空间结构是______,C的杂化方式为______。
(3)乙二胺能与Mg2+离子形成稳定环状离子:[Mg(C2H8N2)2]2+,其结构如图所示:
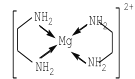
则该环状离子中镁离子的配位数为______。
(4)已知阿伏加德罗常数为NA,立方硫化锌(M=97g/mol)晶胞如图所示:
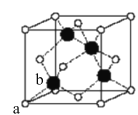
其晶胞棱长为δpm、则其密度为______g/cm3(用含δ的代数式表示);其中顶点位置a的S2-离子与其相邻位置b的Zn2+离子之间的距离为______pm(用含δ的代数式表示)。a位置的S2-离子和b位置的Zn2+离子的分数坐标依次为:______、______。(已知:1m=102cm=1012pm)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是
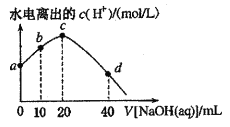
A. a点溶液中:c(H+)=6.0![]() 10-3mol
10-3mol![]() L-1
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com