江西省南昌二中2008―2009学年度高三年级第四次阶段性考试
化 学 试 题
相对原子质量:
C―12 N―14 O―16 S―32 Na―23 K―39 Ca―40 Cu―64
第I卷(选择题 共54分)
一、选择题(本题包括18小题,每小题只有一个选项符合题意,每小题3分)
1.下列说法摘自一些科普杂志或广告用语,你认为没有科学性错误的是 ( )
A.化学家采用玛瑙研酬磨擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
B.夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
C.“白雪牌”漂粉精,令所有化学物质黯然失“色”,没有最白,只有更白
D.硅的提纯与应用,促进了半导体元件与集成芯片业的发展,可以说“硅是信息技术革命的催化剂”
试题详情
2.在NH3、HNO3、H2SO4的工业生产中,具有的共同点是 ( )
A.使用吸收塔设备 B.使用尾气吸收装置
C.使用H2作原料 D.使用催化剂
试题详情
3.充分利用能源、提高原子利用率、减少向环境排放废弃物等都是绿色化学基本要求。
①在有机实验中,用溴的四氯化碳溶液代替溴的水溶液;
②
用稀硝酸代替浓硝酸溶解、回收含银镜试管里的银;
③
用水浴加热代替直接用洒精灯加热;
④
接触法制硫酸中采用“热交换器”,利用余热预热冷原料气和烧水;
⑤
工业合成氨中分离产物得到氢气和氮气再循环使用;
⑥
电解法冶炼钠和镁,选择电解氯化钠和氯化镁,不电解对应的金属氧化物。
上述主要不是从绿色化学角度考虑的是 ( )
A.①③ B.②④ C.⑤⑥ D.③④
试题详情
4.下列说法正确的是:
( )
①经分析某物质只含有一种元素,则该物质一定是单质;
②质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;
③碱性氧化物一定是金属氧化物;
④NO2不是酸酐、Na2O2不属于碱性氧化物;
⑤两种盐溶液反应一定生成两种新盐。
A.①③④
B.②③④ C.②③⑤ D.①③⑤
试题详情
试题详情
 A.晶体硅是良好的半导体材料
A.晶体硅是良好的半导体材料
试题详情
 B.二氧化硅能与石灰石反应:SiO2+CaCO3
CaSiO3+CO2↑
B.二氧化硅能与石灰石反应:SiO2+CaCO3
CaSiO3+CO2↑
C.可以用焦炭还原二氧化硅生产硅:SiO2+2C
Si + 2CO↑
D.水泥的主要成分是Na2SiO3、CaSiO3和SiO2
试题详情
6.下列说法正确的是 ( )
A.我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B.工艺师利用盐酸刻蚀石英制作艺术品
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.粗硅制备单晶硅涉及氧化还原反应
试题详情
7.C3N4和Si3 N4晶体结构相似,是新型的非金属高温结构陶瓷.下列说法正确的是( )
A.C3N4和Si3 N4中N的化合价为+3
B.C3N4和Si3 N4易与水反应生成NH3
C.C3N4和Si3N4中含有共价键 D.C3N4晶体的硬度比Si3N4晶体的小
试题详情
8.英国研究人员 2007 年 8 月 30 日发表报告认为,全球将有 1.4 亿人因为用水而受到砷中毒之害、导致更多的人患癌症。海带含砷超标,经水浸泡 24 小时后,其含砷量才能达到食用安全标准。下列对砷 ( As )的有关判断正确的是 ( )
A.砷原子序数为 33 ,它与铝为同主族
B.砷的原子半径小于磷的原子半径
C.砷化氢的稳定性比溴化氢的强
D.砷酸的酸性比硫酸的弱
试题详情
9.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是 ( )
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
试题详情
10.将1.92g铜粉投入到一定高考资源网版权所有量的浓硝酸中反应,当铜完全作用时,生成的气体颜色越来越浅,共收集到气体672ml(标况下),将盛有此气体的容器倒扣在水槽中,通入标准状况下的一定体积的氧气,恰好使气体完全溶于水,则所通入氧气的体积为 ( )
A.504ml B.336ml C.224ml D.168ml
试题详情
11.下列离子方程式正确的是 ( )
A.在硫酸铜溶液中加www.1010jiajiao.com入过量氢氧化钡溶液:Ba2++SO42―=BaSO4↓
B.碳酸氢钠溶液与少量石灰水反应:2HCO3―+Ca2++2OH―=CaCO3↓+CO32-+2H2O
试题详情
C.向氯化铝溶液中加入过量氨水:A13++4NH3?H2O A1O2―+4NH4++2H2O
A1O2―+4NH4++2H2O
D.NH4HCO3溶液与过量NaOH溶液反应:NH4+ + OH― = NH3↑+ 2H2O
试题详情
12.下列有关化学工业生产的说法正确的是 ( )
A.合成氨工业中可以设法只改变一个条件,使正反应速率增大,逆反应速率减小,
平衡向正反应方向移动
试题详情
B.接触法制硫酸中,增大压强可以使平衡2SO2(g)
+ O2 (g)  2SO3(g)向正反应方向移动,因此工业中常采用高压
2SO3(g)向正反应方向移动,因此工业中常采用高压
C.氯碱工业中NaOH在阴极区产生
D.侯氏制碱法得到的产品主要是烧碱
试题详情
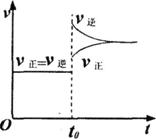 13.往一体积不变的密闭容器中充入H2和I2(g),发生反应:H2(g)+I2(g)
13.往一体积不变的密闭容器中充入H2和I2(g),发生反应:H2(g)+I2(g)
 2HI(g);ΔH<0,当达到平衡后,改变反应的某一条件(不再充入任何气体),
2HI(g);ΔH<0,当达到平衡后,改变反应的某一条件(不再充入任何气体),
造成容器内压强增大,下列说法正确的是
( )
A.容器内气体颜色变深,平均相对分子质量增大
B.平衡向右移动,HI浓度增大
C.改变条件前后,速率图象如右图
D.平衡不移动,混合气体密度不变
试题详情
14.对可逆反应 4NH3(g )+5O2 ( g)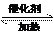 4NO(g)+ 6H2O ( g ) ,下列叙述正确的是 ( )
4NO(g)+ 6H2O ( g ) ,下列叙述正确的是 ( )
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的 n (NH3 ) : n (O 2 ) = 4:5
B.反应达到平衡后,对体系一直进行加压,平衡总是向逆向移动
C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动
D.当v正(NH3 ) : v正(NO)= l : 1 时,说明该化学反应已经达到平衡
试题详情

A.x可能等于3 B.向平衡后的乙容器中充入氦气可使A的转化率降低
试题详情
C.将乙容器单独升温,c(A)可达到0.78mol/L 试题详情
D.若向甲容器中再充入2molA、4molB,平衡时甲容器中c(A)大于1.56mol/L 试题详情
16.密闭容器中,反应xA(g) + yB(g)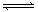 zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是 ( ) zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是 ( ) A.x+y < z
B.平衡向正反应方向移动 C.B的质量分数增大
D.A的体积分数下降 试题详情
17.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将13.8g样品加入足量水中,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀。下列对样品所含杂质的正确判断是 ( ) A.肯定没有KNO3 B.肯定有KNO3,可能还有Na2CO3 C.肯定没有Ba(NO3)2,可能有KNO3 D.肯定没有Na2CO3和Ba(NO3)2 试题详情
18.用CH4催化还原 NOx可以消除氮氧化物的污染。例如: ① CH4 ( g ) + 4NO2
( g ) = 4NO ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一574kJ?mol-1 ② CH4 ( g ) + 4NO ( g )
= 2N2 ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一1160kJ?mol一1 下列说法不正确的是 ( ) A.由反应 ① 可推知:CH4 ( g ) + 4NO2
( g ) = 4NO ( g ) + CO2 ( g ) + 2H2O ( l) ; △H >一574 kJ?mol-1 B.反应 ①② 转移的电子数相同 试题详情
C.若用标准状况下 4.48LCH4 还原 NO2至 N2,放出的热量为 173.4kJ。 试题详情
D.若用标准状况下 4.48LCH4 还原 NO2至 N2,整个过程中转移的电子总数为 试题详情
试题详情
19.(8分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、 HCO3-、Cl-等,取该溶液进行如下实验: ①用蓝色石蕊试纸检测该溶液,试纸显红色; ②取溶液少许,加人铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色; ③取溶液少许,加人氨水有白色沉淀生成,继续加人过量氨水,沉淀不消失; ④取溶液少许,滴人氯化钡溶液产生白色沉淀; ⑤取实验 ④ 后的澄清溶液,滴人硝酸银溶液产生白色沉淀,再加人过量的稀硝酸,沉淀不消失。
请回答下列问题: (l)在实验 ① 中,下图所示的操作中正确的是___________(填代号) 试题详情

(2)根据上述实验判断原溶液中肯定存在的离子是_______________________,肯定不存在的离子是______________________________________________。
(3)写出与实验③的离子方程式: _____________________________________________________________ 试题详情
20.(10分)某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究: (一)制取氨气 (1)写出实验制取氨气的化学方程式
; (2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的? (填“能”或“否”)。 试题详情

(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是 。 (2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式
。 (三)问题讨论:
试题详情
 有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:
; 有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:
;
试题详情
21.(16分)合成氨工业对化学工业和国防工业具有重要意义;合成氨的原料为_________。
工业上合成氨的主要生产过程有:
(1)原料气的制备、净化和压缩: 试题详情
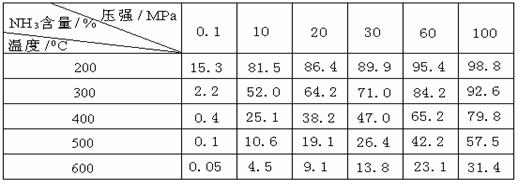 (2)氨的合成:工业合成氨时将N2和H2按体积比为1 :3通入______________中(填工业设备)。在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:①根据表中数据并应用化学平衡移动原理,分析为提高平衡混合物中NH3的含量,可采取的措施是
(多选或选错均不给分) (2)氨的合成:工业合成氨时将N2和H2按体积比为1 :3通入______________中(填工业设备)。在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:①根据表中数据并应用化学平衡移动原理,分析为提高平衡混合物中NH3的含量,可采取的措施是
(多选或选错均不给分) A.增大压强
B.减小压强 C.提高温度
D.降低温度 试题详情
 ②根据表中数据,画出在30MPa下, ②根据表中数据,画出在30MPa下,
NH3的百分含量随温度的变化曲线图。 试题详情
③若生产1 mol NH3时放出46.2kJ热 量,写出合成氨的热化学方程式 _________________________________。 ④合成氨的适宜条件为______________; 在500℃、30 MPa条件下反应达到平衡时 H2的转化率为
;若在某条件下平衡混合物中NH3的百分含量为a%,原混合气体与平衡混合气体的总物质的量之比为
(用含a的代数式表示)。 (3)氨的分离:工业上采用
法将氨分离出来。 试题详情
22.(8分)t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发 试题详情
 生如下反应:3A(g)+B(g) xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol?L―1,请填写下列空白: 生如下反应:3A(g)+B(g) xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol?L―1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成B的平均反应速率为
。 (2)x=
,。 (3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)
。 A.向正反应方向移动 B.向逆反应方向移动 C.不移动 (4)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为
。 试题详情
23.(12分)某学生将2.4 g红热的固体单质甲投入显黄色的足量的溶液乙中,共热剧烈反应,产生混合气体A。用A再作如下实验:
操作(Ⅱ) 操作(Ⅰ) 按要求填空: (1)甲的名称为 ,乙溶液显黄色是因为
。
试题详情
 (2)甲与乙反应的化学方程式为
。 (2)甲与乙反应的化学方程式为
。
试题详情
(3)若A与水反应所得酸溶液的体积为80ml、浓度为0.5mol/L,单质丙为1.92g;操作(Ⅱ)的化学方程式为
。再向其中加入20mol浓度为0.5mol/L的H2SO4,则所得蓝色溶液C中丙离子的浓度为
;
(4)在标准状况下将操作(Ⅰ)中产生的B气体全部收集于试管中,将该试管倒置于水槽中。向该试管中通入一定量标准状况下的O2,试管充满了溶液。①求通入O2的体积
;②若试管中的溶液不扩散,求所得溶液的物质的量浓度 。 试题详情
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 D D A B D D C D B B B C C A C C B A 19.(8分)( 1 ) B D ( 2 分) (2)一定有 NO3-、Al3+、SO42-(2分); 一定无 Fe3+、Ba2+、HCO3-(2分) (3) Al3+ + 3 NH3?H2O = Al(OH)3↓+3NH4+ (2分)  20.(10分)(一)(1)2NH4Cl
+ Ca(OH)2 CaCl2+2NH3↑+2H2O (2分) 20.(10分)(一)(1)2NH4Cl
+ Ca(OH)2 CaCl2+2NH3↑+2H2O (2分)
20090109  (二)(1)在装置A与B之间增加装有碱石灰的干燥管(2分) (二)(1)在装置A与B之间增加装有碱石灰的干燥管(2分)
(2)3CuO+2NH3
3Cu+N2+3H2O(2分)
(三)(1)取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O反之则没有(2分) 21.(16分)含碳燃料(焦炭、天然气)、水、空气;(2分) (2)合成塔(1分)
; 5000C、20-50MPa、铁触媒(2分)
 ①A D(选对一个给1分,多选或错选不得分)(2分) ①A D(选对一个给1分,多选或错选不得分)(2分)
②见右图(2分) ③N2(g) + 3H2(g)  2NH3(g) ; 2NH3(g) ; ΔH = ―92.4kJ/mol ( 2分)  ④41.8% ;
每空2分 ④41.8% ;
每空2分
(3)液化(1分) 22.(8分)0.05mol?L―1?min―1
(2分) (2)x=4 (2分) (3)C(2分) (4)n(A)=3n(B) n(C)、≥0(2分) 23.(12分) (1) 碳(1分)
; 硝酸分解产生的NO2溶于硝酸中(1分)。(以下每空2分) (2)C+4HNO3(浓)  CO2↑+4NO2↑+2H2O 。 CO2↑+4NO2↑+2H2O 。 (3)3Cu+ 8HNO3=3Cu(NO3)2+2NO↑+4H2O
;
0.225mol/L 。 (4)① 4.48 L ;② 1/22.4 mol/L 。
| | | | | | | |

 A.晶体硅是良好的半导体材料
A.晶体硅是良好的半导体材料 B.二氧化硅能与石灰石反应:SiO2+CaCO3
CaSiO3+CO2↑
B.二氧化硅能与石灰石反应:SiO2+CaCO3
CaSiO3+CO2↑ A1O2―+4NH4++2H2O
A1O2―+4NH4++2H2O 2SO3(g)向正反应方向移动,因此工业中常采用高压
2SO3(g)向正反应方向移动,因此工业中常采用高压 13.往一体积不变的密闭容器中充入H2和I2(g),发生反应:H2(g)+I2(g)
13.往一体积不变的密闭容器中充入H2和I2(g),发生反应:H2(g)+I2(g)
 2HI(g);ΔH<0,当达到平衡后,改变反应的某一条件(不再充入任何气体),
2HI(g);ΔH<0,当达到平衡后,改变反应的某一条件(不再充入任何气体), 4NO(g)+ 6H2O ( g ) ,下列叙述正确的是 ( )
4NO(g)+ 6H2O ( g ) ,下列叙述正确的是 ( )