2009.1
![文本框: 注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共8页,包含选择题[第1题~第14题,共48分]、非选择题[第15题~第21题,共72分]两部分。本次考试时间为100分钟,满分120分。考试结束后,请将答题卡交回。
2.答题前,请考生务必将自己的学校、班级、姓名、学号、考生号、座位号用0.5毫米的黑色签字笔写在答题卡上相应的位置。
3.选择题每小题选出答案后,请用2B铅笔在答题卡指定区域填涂,如需改动,用橡皮擦干净后,再填涂其它答案。非选择题请用0.5毫米的黑色签字笔在答题卡指定区域作答。在试卷或草稿纸上作答一律无效。
4.如有作图需要,可用2B铅笔作答,并请加黑加粗,描写清楚。](http://pic.1010jiajiao.com/pic4/docfiles/down/test/down/7ca2051ee38ca25fbd1b70338b277766.zip/59736.files/image001.gif)
第Ⅰ卷(选择题 共48 分)
本卷可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32 Cl:35.5 Fe:56 Cu:64 Ag:108
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.美国科学家马丁・查非(Martin Chalfie)、美国华裔化学家钱永健(Roger Tsien)以及日本科学家下村修(Osamu Shimomura)因发现和研究绿色荧光蛋白(green fluorescent protein,GFP)而获2008年度诺贝尔化学奖。GFP在紫外线照射下会发出鲜艳绿光。下列有关说法正确的是
A.重金属离子能使GFP变性 B.天然蛋白质属于纯净物
C.GFP发出荧光是蛋白质的颜色反应 D.蛋白质通常用新制氢氧化铜检验
试题详情
2.已知:①2H2(g) + O2(g)
= 2H2O(l) △H =-571.6 kJ?mol-1
试题详情
②H+(aq)
+ OH-(aq) = H2O(l) △H = -57.3kJ?mol-1。下列说法中错误的是
试题详情
A.①式表示25℃,101 kpa时,2 mol H2和1 mol O2完全燃烧生成2 mol H2O(l)放热571.6 kJ
试题详情
B.2H2(g)
+ O2(g) = 2H2O(g)中△H大于-571.6 kJ?mol-1
试题详情
C.将含1 mol NaOH的水溶液与50 g 98%的硫酸溶液混合后放出的热量为57.3 kJ
试题详情
D.将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量小于57.3 kJ
试题详情
3.用NA表示阿伏加德罗常数的值,下列说法正确的是
试题详情
A.100
mL 1 mol?L-1的Na2S溶液中离子总数为0.3NA
试题详情
B.2.3
g Na在空气中完全燃烧失去0.1 NA个电子
C.1 mol
C2H4分子中共用电子对数目为5NA
试题详情
D.标准状况下,44.8 L CCl4中含2NA个分子
试题详情
4.下列说法正确的是
A.用干馏的方法可将煤焦油中的苯等芳香族化合物分离出来
试题详情
B.用50 mL碱式滴定管准确量取25.00 mL的KMnO4溶液
C.检验SO2中是否含有CO2,应将气体依次通过氢氧化钠溶液和澄清石灰水
D.分离苯和水时,水从分液漏斗下端流出,苯从上口倒出
试题详情
5.利用相关数据作出的推理或判断一定正确的是
A.用弱酸的电离常数比较相同条件下强碱弱酸盐溶液的碱性强弱
B.用物质熔沸点数据推断出物质的晶体类型
C.根据溶液的pH判断该溶液的酸碱性
D.根据焓变是否小于零判断反应能否自发
试题详情
试题详情
A.常温下将0.1 mol?L-1 NH4Cl溶液与0.05
mol?L-1 NaOH溶液等体积混合,
c (Cl-)> c
(Na+)> c(NH4+)> c
(OH-)> c (H+)
B.常温下物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>②
试题详情
C.0.1mol?L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A)
试题详情
D.在相同条件下,将足量AgCl加入等体积的①0.01 mol?L-1 KCl②0.1 mol?L-1 KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
试题详情
7.下列各组离子在指定溶液中可能大量共存的是
A.由水电离的c (H+)=10-12mol?L-1的溶液中:Cl-,Na+,NH4+,SO32-
B.加入铝能放出H2的溶液中:Mg2+,NO3-,Na+,SO42-
C.碱性溶液中: Na+,ClO-,I-,S2-
D.使甲基橙变红的溶液中:Al3+,Cl-,Na+,SO42-
试题详情
8.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:① 2Sb2S3+3O2+6Fe=Sb4O6+6FeS ②Sb4O6+6C=4Sb+6CO。关于反应①、②的说法正确的是
A.反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3 mol FeS时,共转移6 mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4┱3
试题详情
二、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.下列反应的离子方程式正确的是
A.AgCl的悬浊液中滴入少量Na2S溶液:2AgCl+S2-= Ag2S+2Cl-
B.纯碱溶液与醋酸反应:CO32-+2H+= H2O+CO2↑
C.
Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.过量CO2通入Na2SiO3溶液中 SiO32-+CO2+H2O
= CO32-+H2SiO3↓
试题详情
10.下列说法错误的是
A.对于反应C(s)+ CO2 (g) =2CO(g) △H >0 ,升高温度会加快化学反应速率
B.合成氨反应中,当3v(NH3)正=2v(H2)逆时,反应达到平衡
C.将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n
mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者
试题详情
D.对于反应PCl5(g)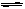 PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小
PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小
试题详情
11.HPE是合成除草剂的重要中间体,其结构简式如下图所示。下列有关HPE的说法正确的是
试题详情
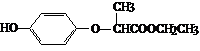 A.含1 mol HPE的溶液最多可以和2 mol NaOH反应
A.含1 mol HPE的溶液最多可以和2 mol NaOH反应
B.HPE不能跟浓溴水反应
C.1 mol HPE能与4 mol H2发生加成反应
D.HPE分子中有2个手性碳原子
试题详情
12.X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期。X原子最外层电子数是其电子层数的3倍。Z原子的核外电子数比X原子少1。M是同周期中半径最大的元素(除稀有气体元素)。下列说法正确的是
A.Y元素最高价氧化物对应水化物的化学式可表示为HYO3
B.Z和M组成的化合物为离子化合物,它与盐酸反应可以生成两种盐
C.X、Y、Z元素的气态氢化物中,Y的沸点最高
D.四种元素简单离子的半径由大到小依次为Y>Z>X>M
试题详情
13.电镀等工业废水中常含有剧毒、致癌的Cr2O72-。该废水处理的一种方法是:利用还原剂把Cr2O72-还原成毒性较低的Cr3+,再加碱生成沉淀。另一种方法是:向废水中加入适当的NaCl,用Fe作电极进行电解。下列说法错误的是:
A.电解时,阳极反应为:Fe―2e-=Fe2+
B.电解过程中阴极能产生氢气
C. 电解法中,转化Cr2O72-的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
D.电解过程中,阳极附近生成Fe(OH)3和Cr(OH)3沉淀
试题详情
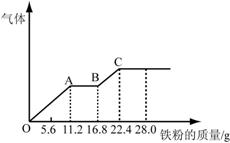 14. 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
14. 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
下列分析或结果错误的是
试题详情
A.混合酸中NO3-物质的量为0.2
mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,
BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为5 mol?L-1
第Ⅱ卷(非选择题,共72分)
试题详情
三、(本题包括1小题,共10分)
15.(10分)氯化亚铜(CuC1),白色结晶,微溶于水,不溶于硫酸、稀硝酸和醇,溶于氨水、浓盐酸,并生成配合物。氯化亚铜广泛应用于有机合成、染料、颜料、催化剂等工业。
试题详情

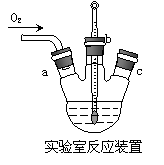
实验药品:铜丝20 g、氯化铵20 g、65% 硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为______,用95%乙醇代替蒸馏水洗涤的主要目的是_________。
(2)工业化生产时,95%乙醇可通过______方法循环利用,而_________、_________(填化学式)可直接循环利用。
(3)实验室实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择___方案(填字母序号)。
试题详情

(4)实验开始时,温度计显示反应液温度低于室温,主要原因是________________;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色;从环保角度考虑,当___________时停止通入氧气,打开瓶塞,沿__________(填字母)口倾出棕色反应液于1 000 mL大烧杯中,加水500 mL,即刻有大量白色沉淀析出。
试题详情
四、(本题包括2小题,共18分)
16.(8分)四氧化三铅俗名“铅丹”或“红丹”,由于有氧化性被大量地用于油漆船舶和桥梁钢架防锈,其化学式可写为2PbO?PbO2。欲测定某样品中四氧化三铅含量,进行如下操作:
试题详情
①称取样品0.1000 g,加还原性酸溶解,得到含Pb2+的溶液。
②在加热条件下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤沉淀。
③将PbCrO4沉淀用酸溶液溶解(离子方程式为2PbCrO4+2H+=2Pb2++Cr2O72-+H2O),加入过量KI溶液,再用Na2S2O3标准溶液滴定到终点(滴定过程中离子方程式为:I2+2S2O32-=2I-+S4O62-)。
(1)已知Pb的原子序数是82,请写出Pb位于周期表的第_____周期______族。
(2)在PbCrO4浊液中加入少量酸,则Ksp(PbCrO4) (填“增大”、“减小”、“不变”)
(3)写出步骤③中加入过量KI后溶液中发生反应的离子反应方程式
。
(4)欲求试样中Pb3O4的质量分数,还需要的数据有
。
试题详情
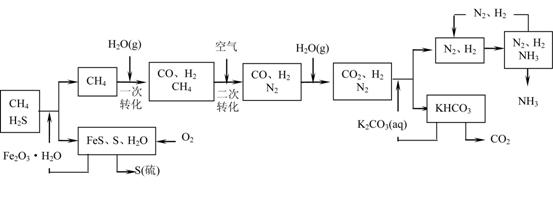 17.(10分)利用天然气合成氨的工艺流程示意图如下:
17.(10分)利用天然气合成氨的工艺流程示意图如下:
依据上述流程,完成下列填空:
(1)图中CH4的第一次转化过程中的化学方程式是
。
(2)脱硫过程中,若有n mol Fe2O3?H2O转化,则生成S的物质的量为 mol(用含n
的代数式表示)。
(3)整个流程有三个循环:一是K2CO3(aq)循环,二是N2和H2循环,第三个循环中被循环物质是
。
(4)改用过量NaOH溶液吸收天然气中的硫化氢,以石墨作电极电解吸收后所得溶液可回收硫,其电解总反应方程式(忽略氧气的氧化还原)为____________________,该方法的优点是____________。
五、(本题包括1小题,共10分)
试题详情
18.(10分)我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中。现以氯化钾和磷酸为原料制取磷酸二氢钾,反应方程式为:
试题详情
H3PO4(aq)+KCl(aq) KH2PO4(aq)+HCl(aq),以下是在三正丁胺中制备磷酸二氢钾的工艺流程:
KH2PO4(aq)+HCl(aq),以下是在三正丁胺中制备磷酸二氢钾的工艺流程:
试题详情


已知:三正丁胺是不溶于水的有机溶剂,与氯化氢反应生成一种可溶于水的盐,能使磷酸二氢钾在水中的溶解度降低。
(1)该流程中所获副产品氮肥的主要成份是
。
(2)使用三正丁胺能促进该反应进行的原因是
。除该方案外,促进该反应进行还可采取的措施有
。
试题详情
(3)当反应时间不同时,产品产率和产品中Cl‑含量变化情况如图所示。KDP晶体的一级品标准:Cl‑质量分数低于0.2%。
试题详情
试题详情
试题详情
试题详情

由图中可知,当反应进行到约
分钟时,KDP晶体达到一级品标准,此时的产品产率约为
。
六、(本题包括1小题,12分)
试题详情
 19.(12分)天然药物白藜芦醇具有抗菌、抗肿瘤、防治冠心病等功能,其合成路线如下:
19.(12分)天然药物白藜芦醇具有抗菌、抗肿瘤、防治冠心病等功能,其合成路线如下:
试题详情

已知:(1)
试题详情

(2)
试题详情
 提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
七、(本题包括1小题,共10分)
试题详情
20.(10分)以海水为原料获取金属镁,其中重要的一步是获得无水MgCl2,然后通过电解法制得金属镁。请回答下列问题:
(1)直接用惰性电极电解MgCl2溶液的化学方程式是 。
(2)工业上一般选择电解无水MgCl2制金属镁而不选用MgO的主要理由是 。
试题详情
(3)某兴趣小组同学取用80.00 g的MgCl2溶液(含镁元素质量分数为15.00%),将其小心蒸干得49.25 g固体(其成分表示为Mgx(OH)yClz•nH2O),为研究其组成进行了如下两实验:
试题详情
实验一:将所得固体全部溶于100
mL 1.50 mol?L-1的硝酸中,再加水稀释至500 mL,测溶液的pH为1;
试题详情
实验二:取实验一稀释后的溶液50 mL向其中加入足量的AgNO3溶液得沉淀12.915 g。
①对于上述两个实验的安排,说法正确的是
;(填字母序号)
A.均要做,否则无法计算
B.均不要做,数据已经足够
C.只要做实验一即可
②试通过计算确定固体的化学式。(要求有计算过程)
八、(本题包括1小题,共12分)
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
21 A.(12分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为
。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点
(填高或低),理由是
。
(3)A的最高价氧化物对应的水化物分子中其中心原子采取
杂化,E的最高价氧化物分子的空间构型是
。
试题详情
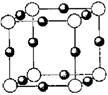 (4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为
.
(4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为
.
(5)A、F形成某种化合物的晶胞结构如右图所示(其中A显-3价),则其化学式为
;(每个球均表示1个原子)
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为 ,其晶体中所含的化学键类型为
。
试题详情
 21 B.(12分)维生素C(C6H8O6,相对分子质量为176)可溶于水,具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定。维生素C通常用标准I2溶液(I2在水中溶解度很小,易溶于KI溶液,I2+I?
21 B.(12分)维生素C(C6H8O6,相对分子质量为176)可溶于水,具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定。维生素C通常用标准I2溶液(I2在水中溶解度很小,易溶于KI溶液,I2+I? I3?,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:
I3?,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:
(1)滴定选用_____(填酸式或碱式)滴定管,滴定所用的指示剂为_______,出现______现象时即为滴定终点。
(2)待测维生素C溶液应在____(填酸性或碱性)介质中配制,可以选择试剂___(填字母)
试题详情
A.0.1 mol?L-1 CH3COOH B.0.1 mol?L-1 HNO3
试题详情
C.0.1 mol?L-1 NaOH D.0.1 mol?L-1 Na2SO3
(3)不能用配制一定物质的量浓度的溶液方法精确配制标准I2溶液,其原因是___(填字母)
A.I2易升华,无法准确称量 B.
I2易被空气氧化
C.I2的溶解度太小,无法制成溶液 D.
加入的KI会影响滴定结果
试题详情
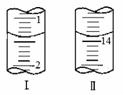 (4)将1.0 g 维生素样品制成100 mL溶液,取25 mL用0.1 mol?L-1的I2溶液滴定,滴定前后滴定管中示数如图,则样品中维生素C的质量分数为_________。
(4)将1.0 g 维生素样品制成100 mL溶液,取25 mL用0.1 mol?L-1的I2溶液滴定,滴定前后滴定管中示数如图,则样品中维生素C的质量分数为_________。
扬州市2008-2009学年度高三第一学期期末调研测试
试题详情
说明:1. 文字简答题以关键词到位为准,按点给分;
2. 化学用语书写:(1)方程式未配平不得分、无条件扣一半分值;
(2)化学式书写错误得0分;
3. 写名称或化学式正确的正常给分; 4. 其他合理解法正常给分。
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
A
C
B
D
A
B
D
B
AC
C
A
BD
D
AD
第Ⅱ卷(非选择题 共72分)
三、(本题包括1小题,共10分)
15.(10分)(1)NH4[CuCl2]
=CuCl↓+NH4Cl(1分),避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分(1分)。(2)蒸馏(1分),NH4Cl、HNO3(2分)。
(3) B(2分) (4)氯化铵溶于水吸收大量热量,造成反应液温度降低(1分)。 烧瓶上方红棕色气体逐渐变为无色(1分),a或c(1分)(答a或答c给分)
四、(本题包括2小题,共18分)
16.(8分)(1)六 ⅣA
(各1分,共2分)(2)不变(2分)
(3) Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O (2分)
(4)Na2S2O3标准溶液浓度和滴定溶液体积(2分)
17.(10分)(1)CH4+H2O
 CO+3H2(2分)(2)n (2分)(3)Fe2O3?H2O(2分)
CO+3H2(2分)(2)n (2分)(3)Fe2O3?H2O(2分)
(4)
优点是:NaOH可以循环利用,同时获得副产品氢气。(各2分,共4分,优点答到“NaOH可以循环利用”即可)
五、(本题包括1小题,共10分)
18.(10分)(1)氯化铵(2分)
(2)原因是降低KH2PO4溶解度,使其析出后,降低了生成物浓度,(同时生成的HCl与三正丁胺反应,也降低了HCl的浓度),使平衡向正反应方向移动。(2分,答到一点即可)。分离出氯化氢(2分,其他合理答案均给分)(3)50―60均可,95%(填近似值即可)(各2分,共4分)
六、(本题包括1小题,共12分)
19.(12分)(1)与生成的硫酸反应,促进平衡向正反应方向移动。(2分)
(2) (2分)
(2分)
(3)2(1分)
(4) (2分)
(2分)
(5)保护A中的酚羟基。(2分)
(6)(3分,第一步正确得2分,完全正确得3分)

电解 20.(10分)(1)MgCl2+2H2OㄔMg(OH)2↓+H2↑+Cl2↑(2分) (2)MgO熔点比MgCl2高,熔化时能耗高(2分) (3)①C(2分) ②n(Mg2+)=0.5mol, n (OH-)= 0.1mol,n (Cl-)=0.9mol,n (H2O))=0.2mol 故n(Mg2+):n (OH-):n
(Cl-):n (H2O) = 0.5:0.1:0.9:0.2=5:1:9:2 即化学式为:Mg5(OH)Cl9?2 H2O(4分) 八、(本题包括1小题,共12分) 下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。 21A.(12分)(1)Na<Al<Si<N(2分) (2)高,NaCl为离子晶体而SiCl4为分子晶体(2分) (3)sp2,平面正三角形(2分) (4)1s22s22p63s23p63d104s1(或[Ar] 3d104s1) [Cu(NH3)4]2+
(2分) (5)Cu3 N (2分) (6)AlN,共价键(2分) 21B.(12分)(1)酸式(1分),淀粉溶液(1分),溶液的蓝色刚好出现,保持半分钟不变色(1分)。 (2)酸性(2分),A(2分)(3)A(2分)(4)88%(3分)
| |
