
0临沂市高三教学质量检查考试
化 学 2009.3 
本试卷分第 I 卷 ( 选择题 ) 和第 E 卷 ( 非选择题 ) 两部分。满分 100 分,考试时间为 100 分钟。 
可能用到的相对原子质量 : H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 
Cl 35.5 K 39 Fe 56 Cu 64 Zn 65 Ba 137
第 I
卷 (选择题 共42分)
一、选择题 (本题包括14个小题,每小题3分,共42分。每小题只有一个选项符合题意)
1. 
A. 奥运会要突出“绿色奥运”理念,是指奥运场馆建设均使用天然材料,不使用合成材料
B. 奥运会期间公交车大量采用丙烷、空气及铂片组成的燃料电池,该电池中通人丙烷的一极是电池的正极
C. 游泳馆“水立方”采用 ETFE[聚氟乙烯(C2H
D. 奥运会奖牌上面镶嵌“玉”,其主要化学成分为含水钙镁的硅酸盐,可用氧化物形式表示,如2CaO•5MgO• 8SiO2•H2O
2. 利用核聚变发电,3He是最清洁最安全的理想物质,地球上氮元素主要以4He形式存,3He仅有15吨左右。而月球上的3He有数百万吨之多,可供全世界开采500年。下列说法正确的是
①3He、4He的化学性质基本相同
②3He、4He 具有相同的中子数
③3He核聚变是化学变化
④3He液化是物理变化
⑤3He、4He形成的单质中均含有非极性键
⑥3He、4He分别组成的气体单质,在相同条件下密度之比为3:4
A. ①②⑤ B. ①④⑥
C. ②③⑤ D. ③③⑥
3. 下列说法不正确的是
A. 静电除尘利用了胶体能发生电泳的性质
B. 液氨、液氯、液态氯化氢都是非电解质
C. 所有的置换反应都是氧化还原反应
D. 使空气中游离态的氮转化为含氮化合物的方法叫做氮的固定
4. 一定温度下的加容电解质AmBn在水溶液中达到沉淀溶解平衡时,其平像了常数Ksp=cm(An+)•cn
(Bm-),称为难溶电解质的溶度积。在
物质
AgCl
AgI
Ag2S
颜色
白
黄
黑
Ksp(
1.8×10-10
1.5×10-16
1.8×10-50
下列叙述不正确的是
A. 溶度积小的沉淀可以转化为溶度积更小的沉淀
B. 
C. 若先加入足量Na2S 溶液,再加入KI溶液,则无黄色沉淀产生
D. 
5. 下列实验操作正确的是
A. 用瓷坩埚灼烧各种钠的化合物
B. 用25mL量筒量取5.2mL稀硫酸
C. 取用金属钠时,应将剩下的大块钠放回原瓶,实验结束,余下的钠屑应用乙醇处理
D. 中和滴定时,应用待测液润洗滴定管和锥形瓶
6. 下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是
A. NaClO溶液中通入过量SO2:ClO-+SO2+H2O===HClO+HSO3-
B. AlCl3溶液中投入过量Na:Al3++4Na+2H2O===AlO2-+4Na++2H2
↑
C. FeBr2溶液中通入少量Cl2:2Fe2++4Br-
+3Cl2===2Fe3++2Br2+6Cl-
D. 向明矾溶液中滴加Ba(OH)2,恰好使SO42-沉淀完全:
2A13++3SO42-+3Ba2++6OH-===
7. 下述实验能达到预期目的的是
编号
实验内容
实验目的
A
将10gCuSO4•5H2O溶解在
配制质量分数为10%的CuSO4溶液
B
将Cl2通入NaBr溶液中
比较氯和溴的氧化性强弱
C
向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
制备Fe(OH)3胶体
D
向某溶液中滴加BaCl2溶液有白色沉淀生成
证明该溶液中一定含有SO42-离子
8. 已知:H2O (g) ===H2O(l)
△H=-Q1kJ? mol-1
CH3OH(g)==CH3OH(l) △H=-Q2kJ?
mol-1
2CH3OH(g)+3O2 (g) === 2CO2(g)+4H2O(g) △H=-Q3kJ? mol-1 (Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)
A. Q1+Q2+Q3
B. 0.5Q3-Q2+2Q1
C. 0.5Q3+Q2-2Q1
D. 0.5(Q1+Q2+Q3)
9. 常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是
A. pH>7, 且c(
B. pH>7,且c (Na+)+ c (H+)= c (CH3COO-)+ c(
C. pH<7, 且c (CH3COO-)>c
(H+)>c (Na+) >c(
D. pH=7, 且c (CH3COO-)= c (Na+)>c (H+)= c(
10. 取下列各组物质中的两种组分各 1mol, 在足量氧气中充分燃烧,两者耗氧量不等的是 学科
学科
A.
乙烯和乙醇 B.
乙炔和乙醛
C.
乙烷和乙酸甲酯 (CH3COOCH3) D.
乙醇和乙酸
11. 在体积都为
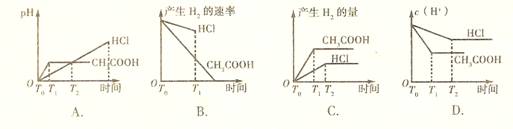

 12.
12.
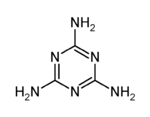
A. 三聚氰氨含有苯环结构,属于芳香族化合物
B. 三聚氰氨中的碳原子属于饱和碳原子
C. 三聚氰氨在一定条件下可能会与氢气发生加成反应 
D. 三聚氰氨能与硝酸发生环上的取代反应
13. 短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A和C同主族,B原子的最外层电子数等于A原子次外层电子数。下列叙述中正确的是
A. 原子半径:A<B<C
B.C 的氢化物稳定性大于A的氢化物的稳定性
C 三种元素的最高价氧化物的水化物均可由化合反应得到
D. 高温下,A单质能置换出C单质
 14. 如右图所示装置,两玻璃管中盛满滴有盼歌溶液的NaCl 饱和溶液,c(I)、c (II) 为多孔石墨电极。断开接通S1 后,c(I)附近溶液 变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转,说明此时该装置形成了原电池。关于该原电池的叙述正确的是
14. 如右图所示装置,两玻璃管中盛满滴有盼歌溶液的NaCl 饱和溶液,c(I)、c (II) 为多孔石墨电极。断开接通S1 后,c(I)附近溶液 变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转,说明此时该装置形成了原电池。关于该原电池的叙述正确的是
A. c (II)的电极名称是负极
B. 外电路电流方向:c(I) → c(II)
C. c(I)的电极反应式为:H2+2OH--2e- ===2H2O
D. 溶液中的Na+向c (I) 极移动




















临沂市高三教学质量检查考试
第II卷 (非选择题 共58分)
化 学 2009.3 
注意事项:
1. 答卷前先将密封线内的项目填写清楚。
2. 第II卷所有题目的答案必须用黑色钢笔或黑色圆珠笔或黑色签字笔答在答题纸上 , 不能答在试卷上,否则元效。
二、 (本题包括2小题,共13分)
15.(5分)某化学小组的同学到实验室学习。在实验桌上摆有下列仪器:
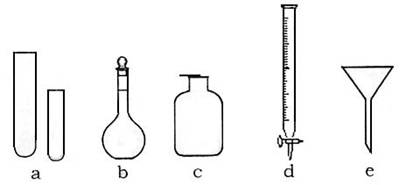
(1)甲同学想用 d 进行实验,请你说出该仪器(已经洗涤干净)使用时的第一步操作:
__________________________________________________________________________
(2)关于e的用途,乙同学说:组成防倒装置。你还能说出其他两种用途吗?
 ①________________________________________;
①________________________________________;
②________________________________________。
(3)丙同学想用右图装置以大理石和稀盐酸反应制取CO2。教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上面的一种仪器,加在装置上,解决了这个问题。
请你把该仪器画在图中合适的位置。
16.(8分)为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如下图的实验装置,分别进行了甲、乙两次实验
实验甲:干燥的二氧化碳和过氧化钠的反应。在干燥的试管II中装入Na2O2,在通人 CO2之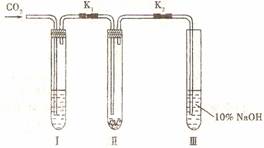 前,关闭K1和K2。在试管I内装入试剂 X 后,打开K1和K2,通人CO2,几分钟后将带火星的木条插入试管III的液面上,观察到木条不复燃,且II中的淡黄色没有变化。
前,关闭K1和K2。在试管I内装入试剂 X 后,打开K1和K2,通人CO2,几分钟后将带火星的木条插入试管III的液面上,观察到木条不复燃,且II中的淡黄色没有变化。
实验乙:潮湿的二氧化碳和过氧化铀的反 应。在试管I内装入试剂Y,其他操作同实验甲。观察到木条复燃,且II中的淡黄色变为白色。
试回答下列问题:
(1)在装入 Na2O2 后,通入CO2前,关闭K1和K2的目的是________________________
________________________________________________________________________。
(2)在实验甲中,试剂X是__________________;在实验乙中,试剂Y是__________________。
(3)根据上述两个实验现象,得到的结论是________________________________________
________________________________________________________。
(4)为了确保实验现象的准确性,制备CO2所用的反应物最好选用__________________(填编号,多选扣分)。
A. 大理石 B. 小苏打 C. 烧碱 D. 盐酸 E. 稀硫酸 F. 稀硝酸
(5)CO2和Na2O2的反应机理可用示踪原子分析加以证明,请完成下列反应方程式:
Na2O2+Cl8O2+H218O →
三、(本题包括2小题,共17分)
17.(10分)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇
2CO2(g)+6H2(g)
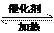 CH3CH2OH(g)+3H2O (g) ①
CH3CH2OH(g)+3H2O (g) ①
2CO(g)+4H(g) 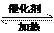 CH3CH2OH(g)+H2O (g) ②
CH3CH2OH(g)+H2O (g) ②
(1)写出反应①的平衡常数表达式 K=_____________。
 (2)条件相同时,反应①与反应②相比,转化程度更大的是_____________。以 CO2为原料合成乙醇的优点是_______________________________________(写出一条即可)。
(2)条件相同时,反应①与反应②相比,转化程度更大的是_____________。以 CO2为原料合成乙醇的优点是_______________________________________(写出一条即可)。
(3)在一定压强下,测得反应①的
实验数据如下表。
根据表中数据分析:
①温度升高,K值___________(填“增大”、“减小”或“不变”)。
 ②提高氢碳比 [n(H2)/n(CO2)],K值__________(填“增大”、“减小”或“不变”),对生成乙醇__________(填“有利”或“不利”)。
②提高氢碳比 [n(H2)/n(CO2)],K值__________(填“增大”、“减小”或“不变”),对生成乙醇__________(填“有利”或“不利”)。
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的影响。图中横坐标的含义是____________________,纵坐标含义是____________________。
18.(7分)强酸制弱酸是复分解反应一条重要规律。这里的“强酸”、“弱酸”指相对的强弱。甚至能呈现酸性的一些非酸类物质,如酚类、两性氢氧化物、酸式盐等参与的反应也可据其酸性强弱运用上述规律来判断其产物。
(1)HA、H2B是两种弱酸,有如下关系:H2B(少量)+
(2)酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中受 NH3影响可发生完全电离。在液氨中CH3COONa+HCl ===NaCl +CH3COOH这一反应能否发生___________(填“能” 或“否”),理由是_________________________________。
(3)某同学实验发现,将H2S气体通入CuSO4溶液中,生成黑色沉淀。弄清沉淀是CuS 后,写出了化学方程式:H2S+ CuSO4===CuS↓ +H2SO4。但随后他陷入了困惑:这不是弱酸制得强酸了吗?与强酸制弱酸的规律矛盾了。请你帮助解释__________________________
_____________________________________________________________。
(4)氧化还原反应中也有类似规律“强氧化性物质制弱氧化性物质”、“强还原性物质制弱还原性物质”,据此判断下列反应能够发生的是______________ ( 填字母编号 ) 。
A. FeCl2 +Cl2→ FeCl3 B. Fe+I2→ FeI3
C. Fe+CuSO4→ FeSO4+Cu D. FeCl3+Cu → CuCl2+FeCl2
四、(本题包括2小题, 共19分)
19.( 10 分 ) 原子序数依次增大的 A、B、C、D、E、F六种短周期元素。元素A的单质是已知密度最小的气体;元素B的单质存在两种以上的同素异形体, 其中之一是自然界中硬度最大的;元素D的最外层电子数是次外层电子数的三倍,D4是新发现的一种同素异形体;E、F位于同一周期,E是同周期元素中原子半径最大的元素。
B、C、D、F四种元素均能与A形成四种等电子分子,分子中各原子的个数比为:
化合物
甲
乙
丙
丁
原子个数比
B:A=1:3
C:A=1:2
D:A=1:1
F:A=1:1
试回答:
(1)C 的元素符号为____________,元素F在元素周期表中的位置_______________,化合物乙的分子式_______________。
(2)0.lmol/L离子化合物 EAB2D4 溶液呈弱酸性,则溶液中离子浓度的大小顺序为
____________________________________________________________。
(3)化合物甲的电子式_______________,A、B、C、D 四种元素中的某三种形成的化合物也与甲分子等电子,请写出其中任意一种物质的分子式_______________。
(4)用来组成酸、碱、盐三类物质至少需要的元素有_____________(填写元素符号)。
20.(9分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、 Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲
(3)在甲溶液中通人过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为
(4)第三份加足量 BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为
根据上述实验回答:
(1)一定不存在的离子是______________,不能确定是否存在的离子是_____________;
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):
离子符号_______________,浓度______________________________;
离子符号_______________,浓度______________________________;
离子符号_______________,浓度______________________________;
(3) 试确定K+是否存在_____________(填“是”或“否”),判断的理由是_____________
______________________________________________________________________________
______________________________________________________________________________
______________________________________________________________________________。
五、选做题(本题包括2小题,可以任选一小题作答,如果都作答则按第一题赋分,共9分)
21.(9分)某种芳香族化合物A,其蒸气的密度是H2的82倍。A由碳、氢、氧三种元素组成,经测定,C、H的质量分数分别为73.2% 和 7.32% 。
(1)A 的分子式是_______________。
(2)已知:①A能使FeCl3溶液变为紫色,但不能发生消去反应;
②在通常情况下,1molA 能与2molBr2发生反应;
③在一定条件下,1molA 最多能与4mol H2发生反应;
④在标准状况下,82gA跟足量的金属钠反应可以得到气体
则A的可能的结构简式是______________________________________(任写两种即可)。A分子中的官能团有____________________________(写结构简式)。
(3)已知

又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)没有写出
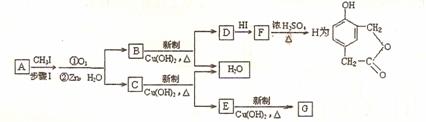
步骤I的目的是:__________________________________________;
若G的相对分子质量为44,则E的结构简式是____________________________;
写出 F → H 的化学方程式:______________________________________________________________________。
22.(9 分 )Mn、Fe 均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元素
Mn
Fe
电离能/kJ•mol-1
I1
717
759
I2
1509
1561
I3
3248
2957
回答下列问题:
(1)Mn元素价电子的电子排布式为______________,比较两元素的I2、I3可知,气态Mn2+ 再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是___________________
____________________________________________________________________________;
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______________;
②六氰合亚铁离子[Fe(CN)64-]中的配体CN-中C原子的杂化轨道类型是___________,写出一种与CN-互为等电子体的单质分子的路易斯结构式______________;
(3)三氯化铁常温下为固体,熔点
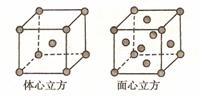 (4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为_____________。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为_____________。
临沂市高三教学质量检查考试
化学第II卷答题纸





湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com