
题目列表(包括答案和解析)
7.玉米是我国的主要农作物之一,雌雄同株异花,是一种非常理想的遗传学实验材料。下面叙述正确的是 ( )
A.在一穗玉米上所结的200粒子粒的基因型应该是相同的
B.作为理想的遗传学实验材料,与豌豆相比,玉米的优势在于雌雄同株
C.杂合的玉米通过单倍体育种方法培育纯合子的过程中,不需要进行植物组织培养
D.玉米的子代数量较多,相对性状差异明显,便于区分与统计,因此是遗传学的良好实验材料
6.下面4项有关生物学实验研究的表述,正确的是 ( )
A.切断小鼠大脑皮层与下丘脑的神经联系,小鼠不能维持体温恒定
B.在检测某人尿液中的含糖量时,用斐林试剂进行鉴定的方法更为简便、有效、精确
C.用带有35S和32P的培养基培养的T2噬菌体分别侵染大肠杆菌,可证明DNA是遗传物质
D.在研究农作物光能利用率的实验中,可将阳生植物和阴生植物放在相同的光照强度条件下进行研究
3.下列关于实验及方法的叙述中,不正确的是 ( )
A.鲁宾和卡门证明光合作用释放的氧全部来自水,设置了对照实验
B.调查不同土壤中小动物类群丰富度时应同一时间分别采集落叶量、不同地域表层土样
C.欲提取叶绿体中的色素应使用纸层析法
D.研究红绿色盲的遗传方式,在患者家系中调查
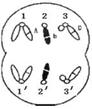 4.右图为二倍体生物细胞的分裂图像,下列叙述中正确的是 ( )
4.右图为二倍体生物细胞的分裂图像,下列叙述中正确的是 ( )
A.该细胞分裂结束后,每个子细胞中含有一个染色体组
B.1与1/、2与2/、3与3/分别为三对同源染色体
C.若1号染色体上的基因为A,正常情况下,1/染色体上相应位点
的基因为A或a
D.该细胞处于有丝分裂后期,分裂结束后形成2个完全相同的子细胞
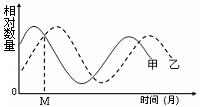 5.右图表示某生态系统中甲、乙两种群在一段时间内数量变化情况。下列有关叙述错误的是
(
)
5.右图表示某生态系统中甲、乙两种群在一段时间内数量变化情况。下列有关叙述错误的是
(
)
A.两个种群间能量流动方向是甲→乙
B.M时甲种群的出生率小于死亡率
C.两个种群数量变化说明了信息传递是双向的
D.两种群数量波动幅度减小说明生态系统正在衰退
1.“观察藓类叶片细胞的叶绿体形态与分布”、“植物根尖细胞的有丝分裂”两个实验的共同点是 ( )
A.实验全过程都要使实验对象保持活性
B.都使用高倍显微镜观察
C.适当提高温度将使实验结果更加明显
D.都需要对实验材料进行染色
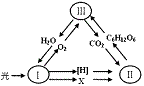 2.右图为绿色植物体内某些代谢过程中物质变化的示意图,Ⅰ 、Ⅱ、Ⅲ分别表示不同代谢过程。以下叙述不正确的是
( )
2.右图为绿色植物体内某些代谢过程中物质变化的示意图,Ⅰ 、Ⅱ、Ⅲ分别表示不同代谢过程。以下叙述不正确的是
( )
A.Ⅲ过程中没有水参加
B.C6H12O6在叶绿体的基质中产生
C.Ⅰ过程产生的O2用于Ⅲ过程的第三阶段
D.X代表的物质是ATP
31. (20分,每空2分)(1)核糖体 转录和翻译 (2)4 非编码区 外显子(3)aaBB、AAbb (4)9:3:3:1 9 9:7 12:4
解析:(1)产氰糖苷酶是蛋白质,核糖体是合成蛋白质的场所;基因指导蛋白质的合成包括转录和翻译两个阶段。(2)基因的基本单位是脱氧核苷酸,脱氧核苷酸有4种。与RNA聚合酶结合的位点位于非编码区;真核生物基因结构的编码区是间隔的、不连续的,其中能够编码蛋白质的序列叫外显子,不能编码蛋白质的序列叫内含子。(3)两株纯合的无毒三叶草杂交, F1均有剧毒,可知F1的基因型为AaBb,因此亲本的基因型为aaBB、Aabb。(4)控制两对性状的基因自由组合,根据自由组合定律,F1配子有16种结合方式,F2表现型有4种,比例为9:3:3:1,基因型有9种。F2植株A_B_占9/16,A_bb、aaB_、aabb占7/16即剧毒与无毒的比为9:7;同理可推出提取物中加入含氰糖苷或提取物中加入氰酸酶后有无氰化物来对F2植株的表现型比例约为12:4。
30. (每空2分,共22分) (1)线粒体(内膜) 叶绿体基质 (2) C3的还原(二氧化碳的还原) (3)下降 升高 (4)不能 乙 (5) 丁 25(6)①第二次镜检时,叶片上气孔关闭的数目比第一次明显增多 ②视野中央
解析:光合作用的光反应场所是类囊体薄膜,暗反应场所是叶绿体基质;有氧呼吸的主要场所是线粒体;光反应产生的[H]用于C3的还原;在图二的乙点突然停止光照,光反应产物[H]、ATP生成量减少,消耗C3相对减少,而二氧化碳的固定正常,则叶绿体内C3的含量将升高;40℃时真光合速率小于呼吸速率,植物体不能显示生长现象;5℃时真光合速率等于呼吸速率;用大棚种植蔬菜时,白天最好控制光强为光饱和点对应的光照强度,温度为真光合速率与呼吸速率之差最大时有机物净积累最多。验证性实验,结果通常是已知的;使用高倍镜前,要先在低倍镜下找到观察物像,并将它移到视野中央,然后转动转换器,换上高倍镜,用细准焦螺旋把视野调整清晰。
29.解析:Ⅰ
(1)题给图像中曲线看起来比较杂乱,不要被表面现象所迷惑,只要仔细分析可发现图中所包含的化学含义。15min-20min、25min-30min两个时间段时三条曲线都跟横坐标平行,即三种物质的物质的量不发生变化,处于平衡状态。在20min这一瞬间,O2的物质的量突然增大,说明此时向反应容器中加入了O2。
(2)10min前后反应都处于不平衡状态,而且O2、SO2的物质的量都是逐渐减小,SO3的物质的量都是逐渐增大;只是10min前变化较缓,10min后变化较快。这是改变了某条件使反应速率加快所造成的。所以,可能是加了催化剂或缩小容器体积。
(3)A选项由左边的2曲线可以看出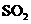 浓度越大,生产成本先是降低后是升高;在B选项中,由左边的1曲线可以看出它是正确的;而选项C中,由右边的曲线可以得出结论是
浓度越大,生产成本先是降低后是升高;在B选项中,由左边的1曲线可以看出它是正确的;而选项C中,由右边的曲线可以得出结论是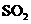 转化率越大,生产成本先是降低后是升高;则选项D也是错误的。
转化率越大,生产成本先是降低后是升高;则选项D也是错误的。
Ⅱ 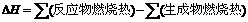 ,由题给信息可知CO燃烧热
,由题给信息可知CO燃烧热
△H=-283.0kJ·mol-1,H2燃烧热△H=-285.8kJ·mol-1,甲醇的燃烧热为-726.5 kJ·mol-1
则CO(g) +2 H2(g)=CH3OH(l) 的 △H=-283-2×285.8-(-726.5)= -128.1 kJ·mo1-1
答案:Ⅰ(1)15~20min和25~30min。(2分)(2)增加了O2的量(2分)。AB(3分)。(3)AB(3分)
II
(1) CO(g) +2 H2(g)=CH3OH(l) △H = -128.1 kJ·mo1-1(3分)
(2)CH3OH-6e+8OH-=CO32-+6H2O (2分)
26.解析:Ⅰ 根据题设条件可推出A为H,B为N,C为O,D为Na,E为S。由A、C、D、E四种元素所组成的化合物可能是NaHSO3或NaHSO4,但NaHSO4不与盐酸反应,可见这种化合物为NaHSO3。在NaHSO3溶液中滴入紫色石蕊试液出现红色,说明溶液呈酸性,可见HSO3―的电离能力大于其水解能力,故溶液中离子浓度大小关系为:c(Na+)>c(HSO3―)>c(H+ )>c(SO32―)>c(OH―)。A、C、D三种元素组成物质的稀溶液为NaOH溶液,Al、Mg片与NaOH溶液构成原电池时,Al自动失去电子,为原电池负极:2Al-6e- + 8OH―=2AlO2― + 4H2O,Mg为正极:6H2O + 6e-=3H2↑+ 6OH―。
26答案:
Ⅰ(1)A为H,B为N,C为O,E为S(4分)
(2)c(Na+)>c(HSO3―)>c(H+ )>c(SO32―)>c(OH―)(3分)
(3)2Al-6e- + 8OH―=2AlO2― + 4H2O(3分)
Ⅱ(1)NaOH (2分)
(2)①2Na2O2 +2CO2
= 2Na2CO3 +O2 (2分) ②2Mg + CO2  2MgO + C(2分)
2MgO + C(2分)
27答案:(1)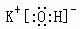 (2分) 硝酸银溶液(1分);4OH-+Al3+=AlO2-+2H2O(2分)
(2分) 硝酸银溶液(1分);4OH-+Al3+=AlO2-+2H2O(2分)
(2)2KClO3 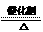 2KCl+3O2↑(2分);分子晶体、离子晶体(2分)
2KCl+3O2↑(2分);分子晶体、离子晶体(2分)
(3)大于(2分);取一定量氯化铝晶体溶于一定量较浓的盐酸中,加蒸馏水稀释至3mol/L的氯化铝溶液(2分)
(4) Al3++3AlO2-+6H2O=4Al(OH)3↓(2分)
解析:除X外,其余物质只含1-20号元素,暗示可能含钾或钙,由信息(a)知,H为氯化银(M=143.5g/mol),X为硝酸银溶液,推知D中含有氯离子;由信息(b)知,A为氯气,I为氧气,联系高一化学基本操作中“氧化铜作氯酸钾分解催化剂”,E可能是氯酸钾,D可能是氯化钾;B为强碱,若为KOH,1molKOH含28mole-符合信息(c)。所以,B为KOH,D为KCl;E为KClO3。再由信息(d)推知,C为氯化铝,G为偏铝酸钾。有关化学方程式:反应①为3Cl2+6KOH 5KCl+KClO3+3H2O
反应②为AlCl3+4KOH=KAlO2+3KCl+2H2O.KCl+AgNO3=AgCl↓+KNO3,氯化铝溶液与偏铝酸钠溶液混合发生反应:Al3++3AlO2-+6H2O=4Al(OH)3↓
5KCl+KClO3+3H2O
反应②为AlCl3+4KOH=KAlO2+3KCl+2H2O.KCl+AgNO3=AgCl↓+KNO3,氯化铝溶液与偏铝酸钠溶液混合发生反应:Al3++3AlO2-+6H2O=4Al(OH)3↓
28答案:(1)碳碳双键、羧基(或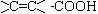 )(4分)
)(4分)
(2)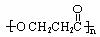 (3分)
(3分)
(3)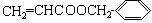 (3分)
(3分)
(4)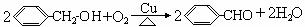 (4分)
(4分)
28解析:A分子式中含有10个碳原子,F分子中含有7个,则B中只含有3个碳原子,B的化学式为C3H4O2,故B中能是丙烯酸;F分子结构中含有苯环,但遇FeCl3溶液不显色,说明不是酚,但是由A水解得到的,分子结构中应该含有羟基,应为苯甲醇;由此可推出A是丙烯酸苯甲酯;G由苯甲醇氧化得来,应为苯甲醛,H为苯甲酸;D分子结构中不含有甲基,又是C的一氯取代物,则D为3-氯丙酸,D在氢氧化钠溶液中水解后得到的是3-羟基丙酸,该有机物发生聚合反应生成的应该是聚酯,其结构简式为: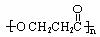
25.(20分)
解:(1)电场力与洛伦兹力平衡得:qE=qv0B得:E=v0B (3分)
(2)根据运动的对称性,微粒能从P点到达Q点,应满足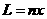 (2分)
(2分)
其中x为每次偏转圆弧对应的弦长,偏转圆弧对应的圆心角为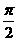 或
或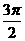 .
.
设圆弧的半径为R,则有2R2=x2,可得: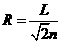 (2分)
(2分)
又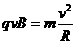 由①②③式得:
由①②③式得: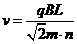 ,n=1、2、3、……
(3分)
,n=1、2、3、……
(3分)
(3)当n取奇数时,微粒从P到Q过程中圆心角的总和为
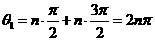 ,(2分)
,(2分)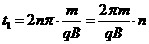 ,其中n=1、3、5、……(2分)
,其中n=1、3、5、……(2分)
当n取偶数时,微粒从P到Q过程中圆心角的总和为:
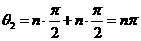 ,(2分)
,(2分)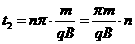 ,其中n=2、4、6、……(2分)
,其中n=2、4、6、……(2分)
 欲使时间最小,取n=1或者2,此时
欲使时间最小,取n=1或者2,此时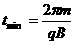 (2分)
(2分)
23.(15分) 解:车的加速度大小由牛顿第二定律知: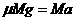
所以 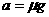 (2分)
(2分)
设车的速度为 V 时车刚好停在标志杆处则:
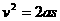
即: 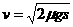 (3分)
(3分)
刹车过程中车的位移为: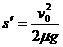 (2分)
(2分)
当 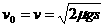 时,车停在标志杆处,车距标志杆的距离
时,车停在标志杆处,车距标志杆的距离
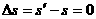 (3分)
(3分)
当 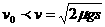 时,车还没达到标志杆处,车距标志杆的距离
时,车还没达到标志杆处,车距标志杆的距离
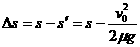 (3分)
(3分)
当 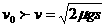 时,车已经驶过标志杆,车距标志杆的距离
时,车已经驶过标志杆,车距标志杆的距离
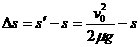 (2分)
(2分)
24题(18分)
解:⑴设第1个球与木盒相遇后瞬间,两者共同运动的速度为v1,根据动量守恒定律:
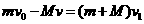 2分
2分
代入数据,解得: v1=3m/s 2分
⑵设第1个球与木盒的相遇点离传送带左端的距离为s,第1个球经过t0与木盒相遇,
则:
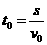 1分
1分
设第1个球进入木盒后两者共同运动的加速度为a,根据牛顿第二定律:
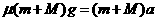 得:
得: 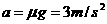 2分
2分
设木盒减速运动的时间为t1,加速到与传送带相同的速度的时间为t2,则:
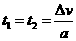 =1s
1分
=1s
1分
故木盒在2s内的位移为零 1分
依题意:
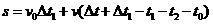 2分
2分
代入数据,解得: s=7.5m t0=0.5s 2分
⑶自木盒与第1个球相遇至与第2个球相遇的这一过程中,传送带的位移为S,木盒的位移为s1,则:
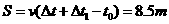 2分
2分
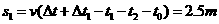 1分
1分
故木盒相对与传送带的位移: 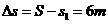 1分
1分
则木盒与传送带间的摩擦而产生的热量是: 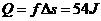 2分
2分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com