
题目列表(包括答案和解析)
37.(8分)[物理--物理3-4]
(1)如图所示,一横波的波源在坐标原点,x轴为波的传播方向,y轴为振动方向.当波源开始振动0.1s时形成了如图所示的波形(波刚传到图中P点).
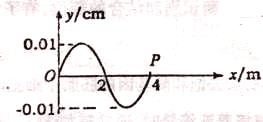
① 问此时刻x=2m处质点的振动方向如何.
②求该波在介质中的传播速度n
(2)一柬光从真空射到某种介质的界面上,传播方向与界面夹角为37。.已知介质的厚度为40m,折射率为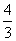 ,求光穿越介质经历的时间.(sln37O=0.6,光在真空中的传播速度为3.0×108m/s)
,求光穿越介质经历的时间.(sln37O=0.6,光在真空中的传播速度为3.0×108m/s)
36.(8分)[物璃--物理3-3]
(1)把熔化的蜂蜡薄薄地涂在两种材料所做的薄片上,用一枝缝衣针烧热后用针尖接触蜂蜡层的背面,熔化区域的形状如甲、乙两图所示,_____________图中(填“甲”或“乙”)
的薄片一定是晶体;液晶的分子排布与液体和固体都有区别.这种捧布使液晶既像液体一
样具有流动性,又具有各向异性,下面_________图(填“丙”或。“丁”)是液晶分子示意图.

(2)用活塞压缩汽缸里的空气,对空气做了900J的功,同时汽缸向外散热210J,汽缸星空气的内能__________________(填“增加”或。减少”)了__________________J.
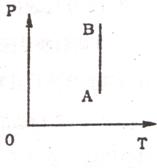
(3)如图所示,是某同学利用DIS实验系统研究一定质量的理想气体的状态变化,得到的P-T图象.气体状态由A变化至B的过程中,气体的体积将____________(填。变大”或。变小”),这是___________(填“吸热”或“放热”)过程
35.(8分)[现代生物科技专题]
 -3脂肪酸是深海鱼所含有的物质,具有重要的药用价值。
-3脂肪酸是深海鱼所含有的物质,具有重要的药用价值。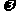 -3脂肪酸去饱和酶可在普通猪体内将其富含的
-3脂肪酸去饱和酶可在普通猪体内将其富含的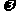 -6饱和脂肪酸转变成
-6饱和脂肪酸转变成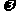 -3脂肪酸。科学家从一种线虫中提取出
-3脂肪酸。科学家从一种线虫中提取出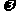 -3脂肪酸去饱和酶基因,导人猪胚胎千细胞中,以期得到富含
-3脂肪酸去饱和酶基因,导人猪胚胎千细胞中,以期得到富含 -3脂肪酸的转基因猪。请回答:
-3脂肪酸的转基因猪。请回答:
(1)从线虫中提取目的基因需要特定的酶,此酶的特点是___________________________。
(2)基因表达载体中,启动子的化学成分是_______________________________________。它位于基因的首端,是___________________________酶识别和结合的部位,有了它才能驱动基因转录出mRNA。
(3)培养导入了 -3脂肪酸去饱和酶基因的胚胎千细胞时,首先要保证细胞处于_____________________的环境;使眉合成培养液培养时,通常需加入_________________等一些天然成分。
-3脂肪酸去饱和酶基因的胚胎千细胞时,首先要保证细胞处于_____________________的环境;使眉合成培养液培养时,通常需加入_________________等一些天然成分。
(4)胚胎移植是培育转基因猪的最后一道工序,为了提高胚胎利用率.可采用胚胎分割技术,用于胚胎分割的胚胎应该是_______________________________________。对胚胎进行分割时,要注意__________________.否则就会影响分割后胚胎的恢复和进一步发育。
(5)你对培育这种转基因猪的安全性有何评价___________________________________。
34.(8分)[生物技术实践] . ·
随着人类基因组计划的进展和多种生物基因组测序工作的完成,人类跨入了后基因、组和蛋白质组时代。对蛋白质的研究与应用,首先要获得纯度较高的蛋白质。请l哥答下列问题:
(1)如果要从红细胞中分离出血红蛋白,实验前取新鲜血液要在采血器中预先加入柠檬酸钠,这样做的目的是__________________________________________。
(2)血红蛋白提取的具体过程可分为:①红细胞的洗涤。具体操作过程是_____
____________________。②_______________;③分离血红蛋白溶液。血红蛋白混合液在离心管中离心后,从上往下数第__________层是红色透阴液体即为血红蛋白的水溶液;④透析。
(3)透析后的样品还需经过凝胶色谱法迸一步纯化,其目盼是______________。
装填凝胶色谱柱时,要注意色谱柱内不能有气泡在,这是因为__________________。
(4)判断纯化的蛋白质是否达到要求,可用电泳法对样品进行_____________,电泳是指______________________________________。
33.(8分)[化学--有机化学基础]
食用香料A分子中无支链,B分子中无甲基.各物质问的转化关系如图(部分产物已略去)。
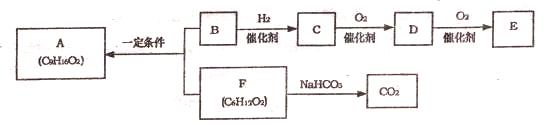
试回答:
(1)在一定条下能与C物质发生反应的是____________(填序号);
a.Na b.Na2C03 c.Br2/CCl4 d.CH3COOH
(2)D分子中的官能团名称是______________,E的结构简式是_____________;
(3)B与F反应生成A的化学方程式是____________________________;
(4)F的同分异构体甲能发生水解反应,其中的一种产物能发生银镜反应;另一产物在光照条件下的一氯取代物只有两种,且催化氧化后的产物也能发生银镜反应。则甲的结构简式是_______________________________。
32.(8分)[化学--物质结构与性质]
 (1)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19OC),甲醇是“假酒”中的主要有害物质(其沸点是64.65℃),甲醇的沸点明显高于甲醛的主要原因是__________;甲醛分子中C的杂化方式为________________________________,分子中有________________个
(1)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19OC),甲醇是“假酒”中的主要有害物质(其沸点是64.65℃),甲醇的沸点明显高于甲醛的主要原因是__________;甲醛分子中C的杂化方式为________________________________,分子中有________________个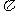 键;
键;
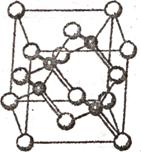
(2)砷化镓属于第三代半导体,它能直接将电能转化为光能已知砷化镓的晶胞结构如右图。试回答下列问题:
①下列说法正确的是___________(选填序号);
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga。
D.砷和镓都属于p区元素
②Ca的核外电子排布式为_________________________;
③砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到,该反应在700℃进行,反应的方程式为____________________;(CH3)3Ga中碳镓键之问键角为_________。
31.(8分)[化学川学与技术]
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氧,MnFe204的制备流程如下:
(1)投入原料Fe(NO3)n.和Mn(N03)2的物质的量之比应为_______________________;
(2)步骤二中“连续搅拌”的目的是_________________________________;
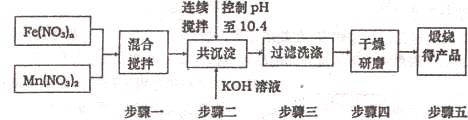
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
请认真分析上述两个反应并回答下列问题:
①从理论上讲,该循环中,1molH2O能制_______________________molH2;
②若MnFe2O4中x=0.8,则MnFe2O4中赠Fe2+占全部铁元索的百分率为______________;
③针对MnFe2O4热化学循环制氢过程存在的不足,你认为热化学循环制氢还需要解决的化学问题是______________________________________________________________________。
30.(14分)Fe2O3、CuO是常见的金属氧化物,请回答有关问题。
(1)查阅资料得知:CuO高温可以分解为Cu2O和O2。某同学为探究“Fe2O3在高温下是否可以分解为FeO和O2”,设计了如下实验方案:将Fe2O3,高温灼烧,看灼烧前后颜色是否变化。
①实验中应将Fe2O3放在________________(填仪器名称)中灼烧。如果高温灼烧后固体颜色由____________变为_____________,则说明Fe2O3,确实发生了变化。你认为生成的是否一定是Fe2O3,理由是_____________________________。
②在上述方案中,除观察颜色变化外,还可据灼烧前后_________________是否变化确定。
(2)某固体粉末X由Fe2O3、CuO组成,某研究性学习小组选用下图装置(夹持仪器已略去,实验前均已检查装置气密性)探究x与过量炭粉发生反应后的产物。
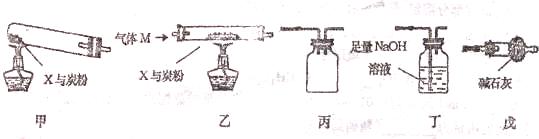

 ①若按“甲 丙
丁”的顺序连接装置,则________________(填上图装置代号)装置中的仪器和试剂需称量。气体经充分吸收后,分析数据发现,消耗碳、氧元素的质量大予生成C02的质量,则说留除产生了C02外,还产生了_________________________气体;
①若按“甲 丙
丁”的顺序连接装置,则________________(填上图装置代号)装置中的仪器和试剂需称量。气体经充分吸收后,分析数据发现,消耗碳、氧元素的质量大予生成C02的质量,则说留除产生了C02外,还产生了_________________________气体;

 ②为使实验测得的数据更能准确说明问题,一些同学按“乙
丁 茂”的顺序连接装置进行实验,并且加热前先通一会儿气体M,停止加热后再通一会儿该气体。该气体可以是下列的 (填字母);
②为使实验测得的数据更能准确说明问题,一些同学按“乙
丁 茂”的顺序连接装置进行实验,并且加热前先通一会儿气体M,停止加热后再通一会儿该气体。该气体可以是下列的 (填字母);
a C02 b.H2 c.N2 d.CO e.O2
停止加热后再通一会气体M的原因是___________________________;
③以上两套装置均存在的同样的明显缺陷是________________________________;
④ 用化学方法证明固体产物的成分(反应后的团体物质中过量炭粉已除去)________
__________________________________________________________
[选做部分]
共8个小题,考生必须从中选择2个物理题、1个化学题和1个生物题在答题卡规定
的区域作答。
29.(14分)现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A元素原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,A、B、C三种元素都能与D元素形成两种或两种以上原子个数比不相同的常见化合物。E为常见金属元素,它与同主族下一周期元素的原子序数之差为18。试回答下列问题:
(1)B的元素符号是_________________,E的原子结构示意图是________________;
(2)均由A、C、D三种元素组成的不同类别的三种常见物质,当它们的水溶液浓度相同时,由水电离出的c(H+)由小到大的顺序为(填化学式):___________________________________
(3)在-定温度下,将3molA2和3molC2两种气体通人容积为lL的恒容密闭容器中,发生反应3A2(g)+C2(g) 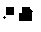 2CA3(g) △H=-92.4KJ·mol-1。当反应达封平衡时,测得容器内的压强为起始时的
2CA3(g) △H=-92.4KJ·mol-1。当反应达封平衡时,测得容器内的压强为起始时的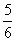 。则此时反应放出的热量为_________________,该条件下反应的平衡常数K=______________________________(小数点后保留2位);
。则此时反应放出的热量为_________________,该条件下反应的平衡常数K=______________________________(小数点后保留2位);
(4)有人设想寻求合适的催化剂和电极材料,以A2、C2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池。试写出该电池的正极反应式 ____________________________。
28.(14分)现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、AL+、Ba+、Mg+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、 X.中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是______________
和__________________(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B。当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕灰色沉淀,向该沉淀中滴人稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解。
①则A为_____________________(填化学式);
②X为下列中的______(填序号); ≯
A 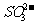 B.
B.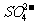 C.
C.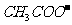 D.
D.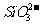 。
。
③将0.02mol的A与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为______________________(精确到0.1g);
④利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、
现象及结论______________________________________________________________。
(3)将Cu投入到盛有D溶液的试管中,Cu不溶解;再滴加稀H2S04,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D一定含有上述离子中的:____________________(填相应的离子符号)。有关反应的离子方程式为____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com