
题目列表(包括答案和解析)
27. (14分,每空2分)淀粉的含量、直链淀粉和支链淀粉的比例及支链淀粉的精细结构等决定着水稻的产量和稻米的品质,因此水稻淀粉合成代谢的遗传研究备受关注。相关研究的部分信息如下图所示。请回答: 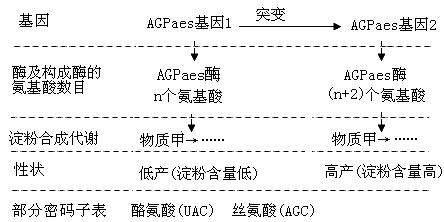
(1) AGPaes基因1通过控制__________________来控制代谢过程,进而使水稻表现低产(淀粉含量低)性状。
(2)用γ 射线处理水稻进行诱变育种。从图中可以看出,由于水稻AGPaes基因1中发生了碱基对的_________,因而突变为AGPaes基因2。比较研究后发现,基因突变部位编码的氨基酸分别为酪氨酸和丝氨酸。请写出基因中编码这两个氨基酸的碱基序列,并标出转录的模板链:__________________。
(3)研究表明,普通野生稻中拥有许多决定稻米优良品质的相关基因。
1)育种工作者利用普通野生稻中存在的低比例直链淀粉突变体,以杂交育种方法培育出了优质栽培水稻品种。在杂交育种过程中,从F2代起,一般要进行多代自交和选择,自交的目的是___________________________,选择的目的是___________________________。
2)普通野生稻含有3.75×104对基因,假定每个基因的突变率都是10-5,那么在约有107个个体的种群中,每一代出现的基因突变数是__________________,它们是进化的原材料,也将是改良栽培稻的资源。我国的普通野生稻分布于南方8个省( 区),每一个分布点的普通野生稻种群都是生物进化的 __________________。
选考部分
第Ⅱ卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卡选答区域的指定位置上。
26.Ⅰ.(14分)下图是利用溶氧量变化来测定黄瓜叶片光合速率的装置。实验在最适温度下进行,反应杯中加入适宜浓度的NaHCO3溶液。
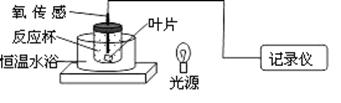
请回答:
(1)黄瓜叶片成熟叶片呈绿色,其原因是 。黄瓜叶片放入反应杯前需抽空叶肉细胞间隙内的气体,目的是 。
(2)随着测试时间的延长,叶片的光合速率逐渐下降,原因是密闭的反应杯中 ,此时,叶绿体中的 碳分子含量上升。
(3)若提高恒温水浴的温度,则光合速率 。若将光源远离反应杯,则光合速率 。
(4)该法同样可用于叶片呼吸强度的测定,不同的处理是需对反应杯 。
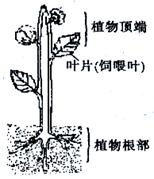 II.(12分)有机物在植物体内的运输是一个复杂的生理过程,环境因素不仅能影响有机物运输的速率,也能影响有机物运输的方向。植物茎上某叶片通过光合作用制造的有机物由于受环境因素的影响,既可能较多地运输到植物的顶端,也可能较多地运输到植物根部(如图所示)。研究发现,运输的方向可能和大气温度、土壤温度两者的温度有关。
II.(12分)有机物在植物体内的运输是一个复杂的生理过程,环境因素不仅能影响有机物运输的速率,也能影响有机物运输的方向。植物茎上某叶片通过光合作用制造的有机物由于受环境因素的影响,既可能较多地运输到植物的顶端,也可能较多地运输到植物根部(如图所示)。研究发现,运输的方向可能和大气温度、土壤温度两者的温度有关。
请你根据所给材料和用品设计“探究大气温度、土壤温度的温差并非对植物有机物运输方向的影响”实验的方法步骤,预测可能的实验结果,并分别得出相应的结论。(已知植物体内有机物运输的适宜温度是22℃,低于15℃有机物运输受限制)材料和用品:几棵完全相同的实验植物,分别能给大气和土壤升降温的仪器、温度计、14C标记的二氧化碳、放射性元素测量仪等。
⑴实验目的:
⑵方法步骤:
①取三棵实验植物,置于三种不同的环境中,对照组 ;实验组-大气温度为15℃,土壤温度为22℃;实验组二大气温度为22℃,土壤温度为15℃;
②分别只给植物上某一片叶(饲喂叶)饲喂 (如上图);
③一段时间后分别测定对照组与实验组一、二中 ,分别记作植物顶端:a、a1、a2和植物根部:b、b1、b2。
(3)预测可能的实验结果及相应的结论。
①如果 ,则说明大气温度大于土壤温度,有利于有机物向顶端运输;大气温度小于土壤温度,有利于有机物向根部运输;
②如果 ,则说明大气温度大于土壤温度,有利于有机物向根部运输;大气温度小于土壤温度,有利于有机物向顶端运输;
③如果a1=a=a2,b1=b=b2,则说明有机物的运输与土壤温度和大气温度没有直接的关系。
25. (16分) 某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因:
①反应放热,一段时间后溶液温度升高,反应速率加快;
②__________________________________________________________________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,同学甲设计如下实验:
药品:0.1 mol·L−1 KSCN溶液;0.1 mol·L−1 KI溶液;0.2 mol·L−1酸性高锰酸钾溶液;氯水;
仪器:试管和滴管
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
|
实验步骤 |
现象 |
结论 |
离子方程式 |
|
第一步 |
取2-3mL溶液装于试管,向试管中加入几滴KSCN溶液。 |
若溶液变红色,则溶液含有Fe3+;若无现象,则不含Fe3+ |
|
|
第二步 |
另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 |
|
|
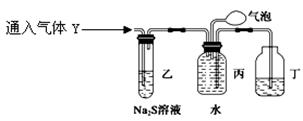 探究二 为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
探究二 为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
(3)装置乙的作用:
。
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO(填“能”或“否”)? 说明理由。
______,_____________________________________________________________________。
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15 mol·L−1酸性KMnO4溶液滴定,消耗20 mL KMnO4溶液。则气体Y中NO、NO2的体积比为 。(已知:NO2−可被MnO4−(H+)氧化为NO3−,同时MnO4−被还原为Mn2+; 2NO2+2NaOH=NaNO3+NaNO2+H2O; NO2+NO+2NaOH=2NaNO2+H2O)
24.(15分)据新闻报道,有全国最“绿”省份之称的福建,近年来却频频受到酸雨的困扰。在饮用水源地水质状况方面,福建9个设区市的34个集中式生活饮用水源地水质达标率为73.3%,较上年同期有所下降。所以保护环境是我们刻不容缓的责任。
Ⅰ.烟气脱硫是控制二氧化硫污染的主要技术手段。
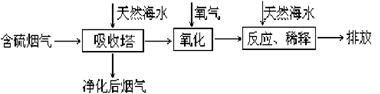
(1)利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
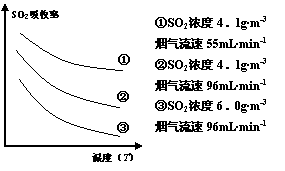 某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水(pH≈8)吸收含硫烟气的模拟实验,实验结果如右图所示。
某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水(pH≈8)吸收含硫烟气的模拟实验,实验结果如右图所示。
①根据图示实验结果,为了提高一定浓度含硫烟气中SO2的吸收效率,下列措施正确的是 。(填字母序号)
A.降低通入含硫烟气的温度
B.减小通入含硫烟气的流速
C.减少天然海水的进入量
D.在天然海水中加入生石灰
②天然海水吸收了含硫烟气后会溶有H2SO3,使用空气中的氧气将其氧化,写出该反应的化学方程式: 。氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 。
(2)石灰石-石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的空气反应生成石膏(CaSO4•2H2O)。写出该反应的化学方程式: 。
Ⅱ.重金属离子对河流及海洋造成严重污染。某化工厂废水(pH≈2)中含有Ag+、 Pb2+等重金属离子,其浓度各约为0.01mol·L−1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
|
难溶电解质 |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
|
Ksp |
8.3×10−17 |
5.6×10−8 |
6.3×10−50 |
7.1×10−9 |
1.2×10−15 |
3.4×10−28 |
(3)你认为往废水中投入 (填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果只用生石灰处理含有Pb2+的废水,使溶液的pH = 8.0,处理后的废水中,c(Pb2+)= 。若环境要求污水综合排放标准为c(Pb2+)低于1.0×l0-8mol·L-1,问处理后的废水是否符合排放标准? (填“是”或“否”)。
23.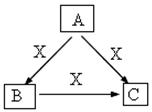 (14分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
(14分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质与某红色氧化物完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为 。
(2)若A为固态非金属单质,X为气态单质,A与X所含元素同周期,常温常压下B、C均为无色气体,C是一种常见的灭火剂。利用原电池原理,将B、X分别通入由A制成的两个多孔电极,以20%-30%的KOH溶液作为电解质溶液,可以组成原电池。该电池放电时,在负极发生电子转移的物质是 (填化学式);正极的电极反应式是 。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用离子方程式表明B 溶液呈碱性的原因 。
②将4.48 L(标准状况下)X通入100 mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为 。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
22.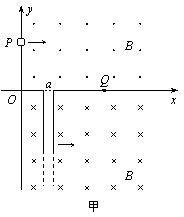 (20分)如图甲所示,在直角坐标系xOy中,第一、四象限存在磁感应强度大小均为B的匀强磁场,方向分别垂直纸面向外和垂直纸面向内。一内壁光滑且与y轴平行的长直玻璃圆管管口a恰好在x轴上。某时刻一质量为m、电荷量为q(q>0)的小球从y轴上P点沿x轴正方向射入磁场中,未进入第四象限之前在Q点(x0,0)恰好无碰撞进入圆管。假设运动过程中小球的电荷量始终保持不变,小球、圆管的重力和空气阻力均不计,圆管直径略大于小球直径。
(1)若管口固定在Q点,求小球射入磁场时的初速度v1大小;
(2)若圆管沿x轴正方向做匀速运动,其运动速度是小球射入磁场时初速度的一半,求小球射入磁场时的初速度υ0大小;
(20分)如图甲所示,在直角坐标系xOy中,第一、四象限存在磁感应强度大小均为B的匀强磁场,方向分别垂直纸面向外和垂直纸面向内。一内壁光滑且与y轴平行的长直玻璃圆管管口a恰好在x轴上。某时刻一质量为m、电荷量为q(q>0)的小球从y轴上P点沿x轴正方向射入磁场中,未进入第四象限之前在Q点(x0,0)恰好无碰撞进入圆管。假设运动过程中小球的电荷量始终保持不变,小球、圆管的重力和空气阻力均不计,圆管直径略大于小球直径。
(1)若管口固定在Q点,求小球射入磁场时的初速度v1大小;
(2)若圆管沿x轴正方向做匀速运动,其运动速度是小球射入磁场时初速度的一半,求小球射入磁场时的初速度υ0大小;
 (3) 在(2)问条件下,小球进入圆管时立即对圆管施加一拉力,使圆管始终与y轴平行且速度不变。求小球在管中沿y轴负方向运动过程所用的时间t0和这段时间内拉力做的功W;
(4) 在(3)问条件下,将小球在管中运动的整个过程中拉力 F 随时间 t 变化的图线画在图乙上(设t = 0 时刻小球刚好进入管口,不必写出分析计算过程)。
(3) 在(2)问条件下,小球进入圆管时立即对圆管施加一拉力,使圆管始终与y轴平行且速度不变。求小球在管中沿y轴负方向运动过程所用的时间t0和这段时间内拉力做的功W;
(4) 在(3)问条件下,将小球在管中运动的整个过程中拉力 F 随时间 t 变化的图线画在图乙上(设t = 0 时刻小球刚好进入管口,不必写出分析计算过程)。
21. (19分)如图所示,PABCD是固定在竖直平面内的光滑绝缘轨道,其中PA是竖直轨道,ABCD是半径为R的圆弧轨道,两轨道在A点平滑连接。B、D分别为圆轨道的最低点和最高点,B、D连线是竖直直径,A、C连线是水平直径,P、D在同一水平线上。质量为m、电荷量为+q的小球从轨道上P点静止释放,运动过程电荷量保持不变,重力加速度为g.
(19分)如图所示,PABCD是固定在竖直平面内的光滑绝缘轨道,其中PA是竖直轨道,ABCD是半径为R的圆弧轨道,两轨道在A点平滑连接。B、D分别为圆轨道的最低点和最高点,B、D连线是竖直直径,A、C连线是水平直径,P、D在同一水平线上。质量为m、电荷量为+q的小球从轨道上P点静止释放,运动过程电荷量保持不变,重力加速度为g.
(1)求小球运动到B点时,轨道对小球的支持力NB大小;
(2)当小球运动到C点时,突然在整个空间中加上一个方向竖直向上的匀强电场,电场强度 ,结果小球运动点D后水平射出,经过一段时间碰到了轨道的Q点,求Q点与P点间的距离s.
,结果小球运动点D后水平射出,经过一段时间碰到了轨道的Q点,求Q点与P点间的距离s.
20.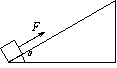 (15分)如图所示,在倾角θ
= 37°的足够长的固定的斜面底端有一质量m
= 1.0kg的物体.物体与斜面间动摩擦因数μ
= 0.25,现用轻细绳将物体由静止沿斜面向上拉动.拉力F = 10N,方向平行斜面向上.经时间t1 = 4.0s绳子突然断了(sin37° = 0.60 ,cos37°
= 0.80,g = 10m/s2).求
(1)绳断时物体的速度大小υ1;
(2)从绳子断了开始到物体再返回到斜面底端的运动时间t
(15分)如图所示,在倾角θ
= 37°的足够长的固定的斜面底端有一质量m
= 1.0kg的物体.物体与斜面间动摩擦因数μ
= 0.25,现用轻细绳将物体由静止沿斜面向上拉动.拉力F = 10N,方向平行斜面向上.经时间t1 = 4.0s绳子突然断了(sin37° = 0.60 ,cos37°
= 0.80,g = 10m/s2).求
(1)绳断时物体的速度大小υ1;
(2)从绳子断了开始到物体再返回到斜面底端的运动时间t
19.(18分)(1)“探究做功与物体速度变化关系”的实验装置,小车在并在一起的相同的伸长橡皮筋作用下弹出,沿木板滑行,获得的速度由打点计时器所打的纸带测出。
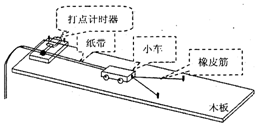 ①为了保证合力对小车所做的功就等于橡皮筋所做的功,需要_________________________;
①为了保证合力对小车所做的功就等于橡皮筋所做的功,需要_________________________;
②下表为一同学实验记录的数据,W代表一根橡皮筋所做的功。请运用表中测定的数据探究出橡皮筋做的功Wn和物体速度υn的关系为_________________________。
③实验中通过改变橡皮筋的数量,而不是改变橡皮筋的伸长量来探究橡皮筋对小车的做功情况,这样做的好处是_________________________。
|
|
橡皮筋 做功Wn |
10个间隔距离x(m) |
10个间隔时间T(s) |
小车获得速度υn(m/s) |
小车速度的平方υn2(m/s)2 |
|
1 |
W |
0.2880 |
0.2 |
1.44 |
2.07 |
|
2 |
2W |
0.4041 |
0.2 |
2.02 |
4.10 |
|
3 |
3W |
0.4896 |
0.2 |
2.45 |
5.99 |
|
4 |
4W |
0.5709 |
0.2 |
2.85 |
8.15 |
|
5 |
5W |
0.6360 |
0.2 |
3.18 |
10.11 |


18.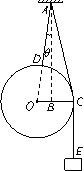 物理学中有些问题的结论不一定必须通过计算才能验证,有时只需通过一定的分析就可以判断结论是否正确。半径为R、质量为M的均匀圆球与一质量为m的重物分别用细绳AD和ACE悬挂于同一点A,并处于平衡,如图所示。已知悬点A到球心O的距离为L,不考虑绳的质量和绳与球间的摩擦,则悬挂圆球的绳AD与竖直方向AB的夹角θ应满足( )
A.sinθ =
B.sinθ =
C.sinθ =
D.sinθ =
物理学中有些问题的结论不一定必须通过计算才能验证,有时只需通过一定的分析就可以判断结论是否正确。半径为R、质量为M的均匀圆球与一质量为m的重物分别用细绳AD和ACE悬挂于同一点A,并处于平衡,如图所示。已知悬点A到球心O的距离为L,不考虑绳的质量和绳与球间的摩擦,则悬挂圆球的绳AD与竖直方向AB的夹角θ应满足( )
A.sinθ =
B.sinθ =
C.sinθ =
D.sinθ =
第Ⅱ卷 必考部分
第Ⅱ卷必考部分共9题,共157分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com