
题目列表(包括答案和解析)
2.
(1) NaHCO3; Al(OH)3
(2) HCO3- + H+ = H2O +CO2↑
(3) Al(OH)3 + 3H+ = Al3+ + 3H2O , Al(OH)3 + OH- = AlO2- + 2H2O
1.
|
应用 |
推测二氧化硅所具有的性质(写出相关方程式) |
|
磨料,加工玉石 |
硬度大 |
|
坩埚 |
熔点高 |
|
石英坩埚不能加热氢氧化钠 |
SiO2 + 2NaOH ==
Na2SiO3 + H2O |
|
用氢氟酸在玻璃上雕花 |
SiO2
+ 4HF == SiF4↑ + 2H2O |
|
普通稀无机酸可清洗 |
化学性质较稳定 |
7.某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
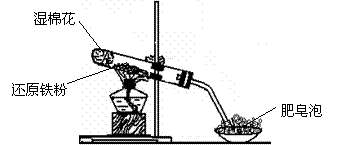
请回答下列问题。
(1)硬质试管中发生反应的化学方程式为 。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是 ,若溶液未变红色则说明硬质试管中固体物质的成分是 。
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
 (用离子方程式表示)。
(用离子方程式表示)。
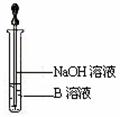
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式
。
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是 ,
并且配制含Fe2+的盐溶液时应加入少量 。
必修1模块常见无机物复习配套练习(三)
6.有一包白色固体(一种二元酸的正盐),下表为进行相关实验的部分实验报告。
(1)请根据实验现象,将你作出的判断填在表格内的相应位置。
|
步骤序号 |
操作 |
实验现象 |
判 断 |
|
① |
取固体溶于水,得溶液X |
得到无色溶液 |
|
|
② |
取少量溶液X,加入氯化钡溶液 |
生成白色沉淀 |
可能含有__________(填离子符号) |
|
③ |
取少量溶液X,加入浓氢氧化钠溶液,加热,并在试管口用湿润的红色石蕊试纸检验 |
试纸变蓝 |
含有_____________(填离子符号) |
|
结论:此白色固体可能是
。 |
(2)若想确认此白色固体的成分,应在步骤 (填步骤序号)中加入试剂A,试剂A为 。
(3)若在步骤②的操作中,加入试剂A后仍有白色沉淀,写出据此确认的溶液X与氢氧化钡溶液加热反应的离子方程式
。
5.实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) ==== MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,氧化剂是 ,如有1 mol Cl2生成,被氧化的HCl的物质的量是
mol,转移电子的物质的量是 mol;
(2)将制得氯气通入冷的消石灰[Ca(OH)2 ]中即可制得漂白粉,其反应的化学方程式是
;在某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,此反应的化学方程式是
;
(3)进行有关氯气的性质实验时,需2.24 L的氯气(标准状况),理论上需要MnO2固体的质量为
。(浓盐酸足量)
(4)前段时间,报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示) 。
4.分类法在化学学习中应用非常广泛。
现有以下5种物质:①SO2、②H2O、③CO2、④CuSO4、⑤CH4和O2的混合气体(体积比为2:1)。
(1)填写下表空白。
|
序号 |
该类别的物质 |
分类标准 |
|
举例 |
①、④ |
都含有硫元素 |
|
A组 |
①、 |
|
|
B组 |
①、 |
|
|
C组 |
①、 |
|
(2)将SO2通入澄清石灰水中,一般看不到明显现象,但是此时向该溶液中滴加NaOH溶液,有白色沉淀生成。请根据(1)中的某组分类分析原因,写出相应的化学方程式。
① 。
② 。
(3)SO2和Fe2+、N2有相似之处。它们的相似之处在下列反应中可以体现,请完成相应的化学方程式。
①SO2 + 2H2S === + 2H2O SO2 + Br2 + 2H2O == +
②Fe2+ + Zn ==== Zn2+ + Fe Fe2+ + Cl2 ==== Fe3+ +2Cl-
③N2 +3Mg 高温 Mg3N2 N2 + O2 放电 2NO
3.某无色透明溶液中可能含有下列离子:K+、H+、Ba 2+、OH-、CO32-、Cl-、NO3-。
若该溶液能与Al反应放出H2。取三支试管,都加入少量反应后的溶液。
①一支滴加一定量的KOH溶液,有白色沉淀生成。
②一支滴加稀硫酸,没有白色沉淀生成。
③一支滴加硝酸银溶液,有白色沉淀生成。
则(1)该溶液中无大量 离子。
(2)该溶液中有 离子。
(3)生成白色沉淀的离子方程式为
。
2.酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸是中和作用缓慢而持久,可维持3-4小时。(2)凝胶本身覆盖于溃疡面上,具有保护作用。(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是 (填化学式);乙中含有的主要化学成份是 (填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:
。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式:
。
24.(8分)称取0.200g某赤铁矿样品,矿样溶解后,使其中的铁全部转化成Fe2+(所得溶液中不含其它还原性物质)。另称取7.90g硫酸铈铵2(NH4)2SO4.Ce(SO4)2.2H2O(摩尔质量为632g·mol-1),溶解后稀释至250ml。取该溶液30ml恰好与上述Fe2+溶液完全反应,反应的离子方程式为Ce4++Fe2+=Ce3++Fe3+。请计算该矿样中Fe2O3
的质量分数(Fe2O3的摩尔质量为160g·mol-1)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com