
题目列表(包括答案和解析)
16.(15分)

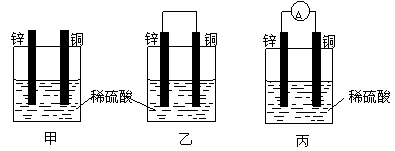 (1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上 (填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上 (填“有”或“没有”)气泡产生。
(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上 (填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上 (填“有”或“没有”)气泡产生。
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。从上述现象中可以归纳出构成原电池的一些条件是 ,
有关的电极反应式:锌片 ;铜片 。
(3)图乙、图丙是一个将 能转化为 能的装置,人们把它叫做原电池。
15.已知化学能与其他形式的能可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是
A.CH4+2O2  CO2+2H2O
CO2+2H2O
B.CaCO3  CaO+CO2↑
CaO+CO2↑
 C.2H2O
C.2H2O  2H2↑
+ O2↑
2H2↑
+ O2↑
D.Pb+PbO2+2H2SO4 2PbSO4+2H2O
14.下列关于原电池的叙述中,错误的是
A.原电池是将化学能转化为电能的装置
B.用导线连接的两种不同金属同时插入液体中,能形成原电池
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.在原电池中,电子流入的一极是正极,发生还原反应
13.工业上合成氨的反应为N2(g)+3H2(g)
 2NH3(g ),为了增大反应速率,提高经济效益,最理想的措施是
2NH3(g ),为了增大反应速率,提高经济效益,最理想的措施是
A.增大反应物的浓度 B.增大反应体系的压强
C.提高反应体系的温度 D.选择合适的催化剂
12.下列有关化学反应速率和限度的说法中,不正确的是
A.实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B.在金属钠与足量水反应中,增加水的量能加快反应速率
C.2SO2+O2
 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D.实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快
11.已知空气-锌电池的电极反应为
锌片:Zn+2OH――2e-=ZnO+H2O;碳棒:O2+2H2O+4e- =4OH- ,据此判断,锌片是
A.正极,被还原 B.正极,被氧化
C.负极,被还原 D.负极,被氧化
10.下列关于物质及其变化的说法不正确的是
A.各种物质都储存有化学能
B.物质发生化学变化时,键的断裂和生成都要释放能量
 C.不少的化学反应都具有可逆性
C.不少的化学反应都具有可逆性
D.物质发生化学变化时,常常伴随有物理变化
9.下列实验中,反应速率加快是由催化剂引起的是
A.在炭粉中加入KClO3,点燃时燃烧更为剧烈
 B.锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快
B.锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快
C.双氧水中加入少量MnO2,可迅速放出气体
D.固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀
8.用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是
A.不用稀硫酸,改用98%浓硫酸 B.加热
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
7.原电池产生电流的本质原因是
A.原电池中溶液能电离出自由移动的离子
B.有导线将两个活动性不同的电极连接
C.正极发生了氧化反应,负极发生了还原反应
D.电极上进行的氧化还原反应中有电子的转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com