
题目列表(包括答案和解析)
30.(6分)1919年,Langmuir提出等电子原理:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是: 和 ; 和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与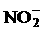 互为等电子体的分子有:
、 。
互为等电子体的分子有:
、 。
29.(13分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周
期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题: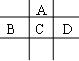
(1) 五种元素的名称:A______,B_____C_______,D_____,E______。
(2)画出C原子、A离子的结构示意图:______________。
(3)B单质在D单质中燃烧,反应现象是______________,生成物的化学式为______________。
(4)A与E形成的化合物的化学式是______________,它的性质决定了它在物质的分类中应属于______________。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至再无明显现象发生时,观察到的现象是_______________________ _______ 。 有关反应的离子方程式为_________________________________
___________________________________________________________
28.(10分).动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
|
实验步骤 |
实验现象 |
|
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
|
②向新制得的Na2S溶液中滴加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
|
③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
|
④将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
|
⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
|
⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,③ ,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)
|
实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
实验现象(填A~F) |
|
|
|
|
|
|
① ,② ,(4)实验结论: 。
27.(2分)在一定条件下,RO3n-和I-发生离子反应如下:
RO3n-+6I-+6H+==R-+3I2+3H2O
⑴RO3n-中R元素的化合价是________;
⑵R元素的原子最外层电子数是__________。
26.(10分)在原子序数为1─18号元素中,与水反应最剧烈的金属元素是______; 化学方程式为________________________。与水反应最剧烈的非金属元素是______;化学方程式为________________________。其中第三周期中,原子半径最大的金属元素是_____; 元素的最高价氧化物所对应的酸最强的是________;单质中熔点最高的是_____;熔点最低的是_____。并用电子式表示MgBr2的形成过程
25.(4分)在O、S、Se、Te四种元素中,单质氧化性最强的化学式是___,简单阴离子还原性最强的离子符号为____. 硒元素最高价氧化物的水化物的化学式为______,它与足量的氢氧化钠溶液反应的化学方程式为_______________ _。
24.已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为
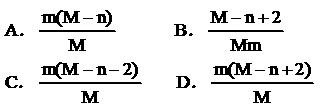
23.同温同压下,体积相同的两个容器中,分别充满由14N、13C、18O三种原子构成的一氧化氮(14N18O)和一氧化碳(13C18O).下列说法正确的是
A.所含分子数和质量均不相同 B.含有相同的质子和中子
C.含有相同的分子数和电子数 D.含有相同数目的中子、原子和分子
22.已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,这两种同位素的原子个数比应为
A. 39︰61 B. 61︰39 C. 1︰1 D.39︰51
21. X和Y均为短周期元素,两者组成的化合物为X3Y2, 若Y的原子序数为m,则X的原子序数不可能是:
A. m+6 B. m+5 C. m-3 D. m-11
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com