
题目列表(包括答案和解析)
3.粗铜的电解精炼
粗铜中通常含有[10] 等杂质,在电解精炼过程中粗铜作[11] ,[12] 作阴极。电解质溶液为用H2SO4酸化的CuSO4溶液。电极反应为:
阳极:Zn-2e-==Zn2+?
Cu-2e-==Cu2+?
阴极:Cu2++2e-==Cu
巩固练习
2.氯碱工业
在饱和NaCl溶液中,存在的阳离子有Na+、H+;存在的阴离子有Cl-、OH-。若用惰性电极电解饱和NaCl溶液,阳极上Cl-先放电,阴极上H+先放电。其电极反应为:
阳极:[7]
阴极:[8]
总反应式为:[9]
1.电解氯化铜溶液(如图)

(1)阴极与电源[1] 相连;阳极与电源[2] 相连。
(2)电子的流向:由电源的负极流向电解池的阴极,电解池的阳极流向电源的正极。
(3)电解质溶液中离子的移动方向:阴离子向[3] 移动,阳离子向[4] 移动。
(4)两电极上发生的反应:

阴极:溶液中阳离子得电子:Cu2++2e-==Cu(反应类型:[6] )
11.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池反应总式都表示为:2H2+O2==2H2O。酸式氢氧燃料电池的电解质是酸,其负极反应可表示为:2H2-4e-==4H+,则其正极反应表示为: ;碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-==4OH-,则其负极反应可表示为: 。
自我反馈
导学园地

? 第三课时 电能转化为化学能
导学园地
10.1991年我国首创以铝-空气-海水为能源的新型“海水电池”,该电池以海水为电解液,靠空气中的氧使铝不断氧化而产生电流。它比干电池能量高?20~50倍。?其总反应式表示为:4Al+3O2+6H2O==4Al(OH)3。
该电源的负极材料为 ,正极材料为 。
(2)写出电极反应:
负极反应: 。
正极反应: 。
9.化学电池在通讯、交通及日常生活中有着广泛的应用。?
(1)化学电池是将 能转化为 能的装置。
(2)下列化学电池不易造成环境污染的是 。
A.锂电池 B.锌锰电池
C.镍镉电池 D.氢氧燃料电池
8.最新研制出一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池。下列有关此电池的叙述错误的是( )
A.正极电极反应:O2+2H2O+4e-==4OH-
B.负极电极反应:CH3OH+8OH--6e-==
C.电池在使用过程中电解质溶液的pH升高
D.当外电路通过0.6 mol电子时,理论上消耗甲醇3.2 g
7.铅蓄电池放电时发生下列变化:
负极:Pb+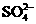 -2e- ==PbSO4
-2e- ==PbSO4
正极:PbO2+4H++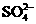 +2e-==PbSO4+2H2O
+2e-==PbSO4+2H2O
使用该电池电解CuSO4溶液,要得到纯铜1.6 g,这时铅蓄电池消耗H2SO4的物质的量为( )
A.0.025 mol B.0.05 mol C.0.1 mol D.0.2 mol
6.设想通过原电池反应以H2和Cl2为原料生产盐酸。关于这种原电池的设想正确的是( )
A.正极反应为H2-2e-==2H+
B.在电池工作时,H+移向负极
C.电池正极发生氧化反应
D.以盐酸作为电解质,并不断补充蒸馏水,以维持溶液一定的pH
5.航天技术上使用一种氢氧燃料电池,它具有高能轻便、不污染环境等优点,该电池总反应方程式为:2H2+O2==2H2O,该电池的正极反应可表示为( )
A.4H++4e-==2H2↑ B.2H2-4e-==4H+
C.4OH--4e-==O2↑+2H2O D.O2+2H2O+4e-==4OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com