
题目列表(包括答案和解析)
4.实验室用MnO2与浓盐酸加热的方法制取氯气.若制得的氯气在标准状况下的体积为2.24 L,则被氧化的氯离子是 ( )
A.0.2 mol B.0.4 mol C.1 mol D.2 mol
答案:A[提示:由反应的化学方程式可知,Cl-被氧化生成Cl2,其物质的量为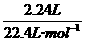 =0.1 mol,则生成Cl2时需氧化0.2 mol Cl-]
=0.1 mol,则生成Cl2时需氧化0.2 mol Cl-]
3.下列气体中,含原子数最多的是 ( )
A.标准状况下11.2 L N2 B.通常状况下11.2 L O2
C.0.4 mol SO2 D.5.3 g NH3
答案:D[提示:先求出分子的物质的量,再换算成原子的物质的量,比较可得]
2.下列说法中,正确的是 ( )
A.1 mol任何物质都含有6.02×1023个微粒
B.硫酸的摩尔质量是98g
C.等质量的SO2和SO3中所含的硫原子数相等
D.等质量的O2和O3中所含的氧原子数相等
答案:D[提示:A项中微粒不明确,如1 mol NaCl含有2×6.02×1023个离子,故A项不正确;摩尔质量的单位为g/mol,故B项不正确;等质量的SO2和SO3的物质的量不相等,故所含S原子数也不相等,故C项不正确;O2、O3均是只由O原子构成的分子,故等质量的O2和O3中所含的氧原子数相等]
1.在标准状况下,1.6 L氮气中含m个分子,则阿伏加德罗常数为 ( )
A.14m B.28m C. 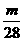 D.7m
D.7m
答案:A[提示:由阿伏加德罗常数的定义可得NA=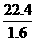 ×m=14m]
×m=14m]
十字交叉法是进行二组分混合物平均量与组分量有关计算的一种简便方法.凡可按M1n1+M2n2=M(n1+n2)计算的问题,均是可用十字交叉法计算的问题,均可按十字交叉法计算,算式为: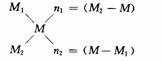
式中,M表示混合物的某平均量,M1、M2则表示两组分对应的量.如M表示平均相对分子质量,M1、M2则表示两组分各自的相对分子质量,n1、n2表示两组分在混合物中所占的比例,在大多数情况下表示两组分的物质的量之比.十字交叉法常用于求解混合气体平均相对分子质量及组成、混合烃平均分子式及组成、同位素原子百分含量、溶液的配制、混合物的反应等.
例7 由CH4和O2组成的混合气体,标准状况下密度为1g/L,则该混合气体中CH4和O2的体积比 ( )
A.2:1 B.1:2 C.2:3 D. 3:2
(分析)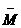 混=1 g/L× 22.4 L/mol=22.4
g/mol.
混=1 g/L× 22.4 L/mol=22.4
g/mol.
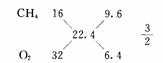
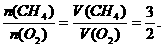
答案:D
例8 在标准状况下,CO和CO2的混合气体20.4g,体积为11.2 L,求混合气体中CO和CO2的体积比和质量比.
[分析] 
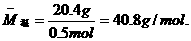
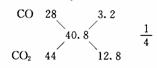
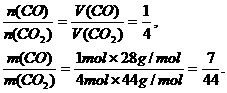
答案:CO和CO2的体积比为1:4,质量比为7:44.
强化训练自我评价
4.根据化学方程式求气体的相对分子质量
例6 150℃时,碳酸铵完全分解,生成的气态混合物其密度是相同条件下 H2 密度的______倍.
(分析) (NH4)2CO3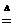 2NH3)+H2O↑+CO2↑
2NH3)+H2O↑+CO2↑
设1 mol(NH4)2CO3完全分解,根据质量守恒,生成气体的总质量为1 mol× M[(NH4)2CO3]=96 g,生成的气体共为4 mol.
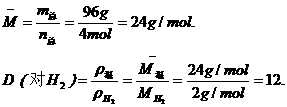
答案:12
1. 求混合气体的平均相对分子质量
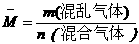 =M(A)×A%+M(B)×B%+……(A%、B%为A、B气体在混合气体中的体积分数)
=M(A)×A%+M(B)×B%+……(A%、B%为A、B气体在混合气体中的体积分数)
例5 已知空气中O2占21%,N2占78%,CO2约占1%,试求空气的平均相对分子质量.
解:M=MA×A%+MB×B%+MC×C%
=32×21%+28× 78%+44×1%
=29.
2.根据气体的相对密度D,求气体的相对分子质量
M(A)=D×M(B)(D为A气体相对于B气体的相对密度,通常是相对于H2、 O2等).
例如,某气体相对于空气的密度是2,则该气体的相对分子质量为58.
1.根据标准状况下的气体密度,求气体相对分子质量
根据标准状况下气体的密度,求该气体的摩尔质量(单位是g/mol),数值上即为气体的相对分子质量.即
M=ρ·22.4 L/mol
例4 已知标准状况下某气体的密度为1.25g/L,则该气体的相对分子质量是多少?
解:由M=ρ·22.4 L/mol得M=1.25 g/L×22.4L/mol=28g/mol,
故该气体的相对分子质量是28.
3.气体密度ρ和相对密度(D)的计算
(1)标准状况:ρ=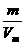 =
=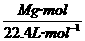 =
=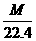 g/L;
g/L;
(2)非标准状况:ρ=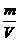 =
=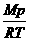 ;
;
(3)同温、同压下,气体的相对密度:D=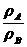 =
=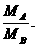 .
.
例1 物质的量为a的CO2气体,体积为x,在同温、同压下,分子数为b的CO气体,其体积是_____.
(分析) n(CO)= 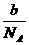 ,同温、同压下,
,同温、同压下, =
=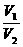 ,得
,得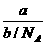 =
=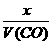 ,V(CO)=
,V(CO)=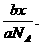
答案: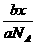
例2 同温、同压下,相同质量的下列气体中,体积最大的是 ( )
A.CO2 B.CH4 C.H2 D.CO
(分析) 由同温、同压下,同质量气体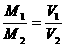 推知,摩尔质量最小者体积最大.
推知,摩尔质量最小者体积最大.
答案:C
例3 已知空气的平均摩尔质量为29 g/mol,在同温、同压下,某气体R对空气的相对密度为2,该气体是 ( )
A.CH4 B.C2H4
C.C2H2 D.C4H10
(分析) 由同温、同压下,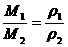 =D,得M1=58g/mol,由选项中各分子的相对分子质量推知该气体为C4H10.
=D,得M1=58g/mol,由选项中各分子的相对分子质量推知该气体为C4H10.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com