
题目列表(包括答案和解析)
1.计算溶质的质量(固体计算质量、液体计算体积)
n(Na2CO3)=V[Na2CO3(aq)]×c(Na2CO3)=0.5 L×0.1 mol/L=0.05 mol,
m(Na2CO3)=n(Na2CO3)×M(Na2CO3)=0.05 mol×106 g/mol=5.3 g.
3.练习容量瓶、滴定管的使用方法.
实验仪器:烧杯、酸式滴定管、容量瓶、胶头滴管、量筒、玻璃棒、药匙、滤纸、托盘天平.
实验原理:使一定物质的量的溶质溶解于溶剂中形成一定体积的溶液.
实验步骤:
如:配制500 mL 0.1 mol/L Na2CO3溶液.
2.加深对物质的量浓度概念的理解.
3.在用容量瓶配制溶液时,如果加水超过了刻度线,倒出一些溶液,再重新加水到刻度线.这种做法对吗?如果不对,会引起什么误差?
点拨 不对.会使所配制的溶液浓度值偏低.
例如:用NaOH固体配制一定物质的量浓度的NaOH溶液,下列情况能使NaOH溶液浓度偏高的是 ( )
A.所用的NaOH固体中混有Na2O B.用托盘天平称取一定质量的NaOH固体时,所用的小烧杯内壁
C.NaOH固体在烧杯中溶解后,立即将溶液转移到容量瓶内
D.最后确定NaOH溶液的体积(定容)时,用仰视法读数
(分析) A项中Na2O与H2O发生化学反应:Na2O+H2O=2NaOH,使NaOH的物质的量偏大;B项中导致小烧杯内壁不太干燥的水的质量,已合在烧杯质量的测得值中,对NaOH物质的量无影响;C项中容量瓶内NaOH溶液温度偏高,实际体积偏小;D项中NaOH溶液体积偏大.
答案:AC
同类变式 配制一定物质的量浓度的KOH溶液时,下列实验操作中对实验结果无影响的是 ( )
A.容量瓶中原有少量蒸馏水
B.有少量KOH溶液残留在烧杯中
C.定容后振荡容量瓶,出现液面低于刻度线,然后又加水至刻度线
D.用托盘天平称量时“左码右物”(假如需KOH 5.6g)
(分析) A项中溶质溶解后转移到容量瓶中,还要继续加蒸馏水,故原容量瓶中有少量蒸馏水不影响浓度;B项中少量KOH溶液残留在烧杯中,减少了溶质的量,使浓度偏低;C项中定容振荡后出现液面低于刻度线,继续加水,使实际配制的溶液体积超过刻度线所示体积,浓度降低;D项中用托盘天平称量应是“左物右码”,天平是一个等臂杠杆,游码就是加在右边的砝码上,若是“左码右物”,这就等于游码加在物体上,增加了物体的质量,在计算物体质量时应从读数中减去0.6 g× 2=1.2 g,即实际称取KOH的质量为5.6 g-1.2 g=4.4 g<5.6 g,使所配溶液浓度偏低.
答案:A
又如:用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是 ( )
A.干燥的 B.瓶塞不漏水
C.用欲制的溶液润洗过的 D.以上三项都要求
(分析) 配制溶液时,要加水,故容量瓶不必干燥;瓶塞若漏水,配制的溶液流出,一是损失,是使所配溶液浓度不准;容量瓶不能用欲制的溶液润洗,否则配制的溶液浓度会偏高.
答案:B
[说明]由容量瓶配制的溶液浓度很精确,要求操作规范,否则容易因浓度不准而作废.
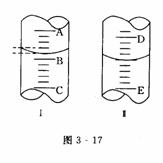
再如:图3-17中,(1)图工表示10 mL量筒中液面的位置,A与B,B与C刻度间均相差1 mL,如果刻度A为4,量筒中液体的体积是_____mL.
(2)图Ⅱ表示50 mL滴定管中液面的位置,如果液面处的读数为a,则滴定管中液体的体积(填代号)_______.
A.是a mL
B.是(50-a)mL
C.一定大于a mL
D.一定大于(50-a)mL
(分析) 本题考查了量筒和滴定管的结构和读数方法,量筒的刻度从下往上刻度数逐渐增大,即0刻度在下面,10mL刻度在上面.滴定管的刻度与量筒恰好相反,从上往下刻度数逐渐增大,即0刻度在上面,50 mL刻度在下面.现在滴定管液面读数为a,若原装有50mL液体,液面在刻度0,现在液面降至a,表示用了a mL液体,在滴定管内装有的液体体积应是50mL-a mL=(50-a)mL,由于滴定管的50mL刻度下还有溶液,即滴定管的容积大于50 ml,故现在滴定管内剩余液体的体积大于 (50-a)mL.
答案:(1)3.2 (2)D
[说明] 本题有两处易出现差错:一是量筒的每一个小刻度代表0.2 mL,不是 0.1 mL;二是50mL滴定管是指它的最大量程是50mL,而其容积大于50 mL,若把容积和量程看成相等,则会错选B项.
还如:现有200mL H2SO4和Na2SO4的混合溶液,其中硫酸的物质的量浓度为 1 mol/L,Na2SO4的物质的量浓度为0.5 mol/L.若要配制H2SO4和Na2SO4的物质的量浓度分别为2 mol/L和0.2mol/L的溶液,应先加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?然后再加蒸馏水至多少毫升?
(分析) H2SO4的浓度由1 mol/L变到2 mol/L,浓度增加了一倍,Na2SO4的浓度由0.5 mol/L变到0.2 mol/L,浓度减小了,不难理解是向混合溶液中加了 H2SO4所致,且变化前后的两种溶液中Na2SO4的物质的量是不变的.
解:先根据稀释定律求稀释后溶液的体积V(稀):
对于Na2SO4来说,200 mL×0.5 mol/L=V(稀)×0.2 mol/L,
解得 V(稀)=500 mL.
再求应加入55.8%的硫酸溶液的体积V(H2SO4):
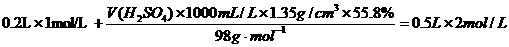 ,
,
解得 V(H2SO4)=104 mL.
故需先加入55.8%的硫酸溶液104 mL,再加蒸馏水至500 mL,即可形成
c(H2SO4)=2 mol/L,c(Na2SO4)=0.2 mol/L的溶液,
答:略.
[说明]本题解题的关键是先求出所配溶液的体积(500mL),然后以此为依据,求加入硫酸液的体积.
实验研究
实验四 配制一定物质的量浓度的溶液
实验目的:1.练习配制一定物质的量浓度的溶液.
2.将烧杯里的溶液转移到容量瓶中以后,为什么要用蒸馏水洗涤烧杯2-3次,并将洗涤液也全部转移到容量瓶中?
点拨 因为烧杯中还会留有溶液,所以要用蒸馏水洗涤干净.如果洗涤液不全部转移到容量瓶中,会影响所配制的溶液的浓度,即所配制的溶液的实际浓度值比理论值偏低.
1.应该怎样称量NaOH固体?
点拨 称量固体氢氧化钠时,不能使用滤纸称量,因为氢氧化钠具有很强的腐蚀性,并且极易潮解,会与空气中的二氧化碳反应.所以在称量固体氢氧化钠时,应将氢氧化钠放在烧杯中,并盖上玻璃片,在称量时动作还应尽可能的快.
27.50 ml-25.90 mL=1.60 mL.
在用滴定管测量液体体积的实际操作中必然要先后两次进行读数,常称其为“初读”和“末读”.
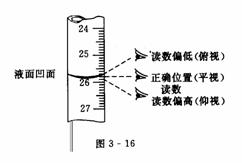
配制一定物质的量浓度的溶液所需液体溶质的体积为既定值,如需要量取某硫酸溶液4.80mL,6.70 mL等.在这里,对于用滴定管量取一定体积的液体,仅就初读和末读引起的液体体积误差的判断方法,用下表和图3-16所示形式说明.
|
读数类型及方式 |
液体体积 |
||
|
末读平视 |
初读 |
仰视 |
偏小 |
|
俯视 |
偏大 |
||
|
初读平视 |
末读 |
仰视 |
偏大 |
|
俯视 |
偏小 |
思维拓展
1.09 mol/L×(300 mL-x)=2.5 mol/L×100 mL,
x=70.6 mL.
答案:(1)62.5 (2)50;50 (3)47.1 (4)33.4;66.6 (5)70.6mL
Ⅳ配制一定物质的量浓度溶液的误差分析
(1)误差的含义
①浓度误差的含义
实际浓度大于预定浓度,误差为“偏大”;实际浓度小于预定浓度,误差为“偏小’.
②定容误差(体积误差)的含义
溶液体积大于容量瓶容积,误差为“偏大”;溶液体积小于容量瓶容积,误差为“偏小”.
③称量(或量取)误差的含义
溶质实际质量(或体积)大于预定质量(或体积),误差为“偏大”;溶质实际质量(或体积)小于预定质量(或体积),误差为“偏小”.
(2)判断误差的方法
①浓度误差的判断方法
浓度误差的判断方法是将称量(或量取)误差和定容误差纳入公式cB中进行判断:
a.V一定,nB增大,cB偏大;nB减小,cB偏小.
b.nB一定,V减小,cB偏大;V增大,cB偏小.
以配制某浓度NaOH溶液为例分析如下:
a.称取时间过长或用滤纸称量,导致n减小,则c偏低.
b.向容量瓶内转移溶液时有少量溅出,导致n减小,则c偏低.
c.未洗涤烧杯和玻璃棒,导致n减小,则c偏低.
d.未冷却至室温即转移入容量瓶,导致V减小,则c偏高.
 e.定容时加水量过多,用滴管吸出,导致n减小,则c偏低.
e.定容时加水量过多,用滴管吸出,导致n减小,则c偏低.
f.定容时仰视,导致V增大,则c偏低.
g.定容时俯视,导致V减小,则c偏高.
h.定容后摇匀,发现液面下降又加水,导致V增大,则c偏低.
②定容误差的判断方法
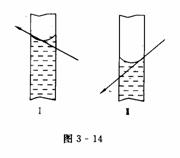
定容的目标是容量瓶的容积,相关的主要方法是平视式,以容量瓶的刻度线为目标,观察液面的凹面与刻度线相切时,液体体积恰好等于容量瓶的体积.
a.仰视式观察,溶液体积偏大(如图3-14Ⅰ所示).
b.俯视式观察,溶液体积偏小(如图3-14 Ⅱ所示).
 ③称量、量取误差的判断方法
③称量、量取误差的判断方法
a.用托盘天平称量固体溶质质量中误差的判断方法(略).
b.用滴定管量取液体溶质体积过程中误差的判断方法.
用滴定管测量液体体积的原理是求差值.如图3-15所示,液面从25.90mL处降到27.50mL处,放出液体的体积为:
6.48 g n(SO2-4)
n(SO2-4)=0.36 mol,
c(SO2-4)=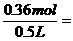 0.72mol/L.
0.72mol/L.
答案:溶液中SO2-4的物质的量浓度为0.72mol/L.
Ⅱ溶液中溶质的质量分数与溶质的物质的量浓度的换算
计算原理:溶质的质量分数和物质的量浓度都可以用来表示溶液的组成,当已知溶液的密度时,溶液中溶质的质量分数和物质的量浓度之间可以通过一定的关系进行换算.若已知含溶质B的溶液密度ρ[B(aq)]和溶质的质量分数w/(B),则有:
1 L溶液(1000 mL溶液)的质量为:
1000mL×ρ[B(aq)]
1 L溶液中所含的溶质B的质量为:
1000 mL×ρ[B(aq)]×w(B)
1 L溶液中所含的溶质B的物质的量为:
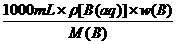
既然求得了1 L溶液中溶质B的物质的量,则该溶液中B的物质的量浓度很容易便可求得.反之,若已知溶液的ρ[B(aq)]和c(B),也能求得w(B).密度是质量分数w(B)与物质的量浓度c(B)之间相互联系的桥梁.
例如:已知98%的浓H2SO4的密度为1.84 g/cm3,求浓H2SO4溶液中H2SO4 的物质的量浓度是多少?
(分析) 直接利用公式:c(H2SO4)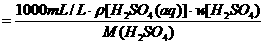
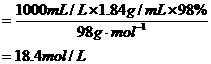
答案:18.4 mol/L.
同类变式 已知某盐酸的密度为1.19g/mol,HCl的物质的量浓度为12mol/L,求该盐酸中HCl的质量分数.
答案:36.8%
又如:20.0g14.0%的NaCl溶液跟30.0 g 24.0%的NaCl溶液在常温下混合,得到密度为1.15g/mL的混合溶液,试求:
(1)该混合溶液中溶质的质量分数;
(2)该混合溶液中NaCl的物质的量浓度;
(3)在1000 g水中需溶入多少摩尔NaCl才能使其浓度恰好与上述混合溶液的浓度相等?
(分析) 溶液中溶质的质量分数 ×100%,混合溶液中溶质的质量应是两种NaCl溶液中NaCl的质量之和,求出w/(NaCl)后,又巳知混合溶液的密度,则可求混合溶液中NaCl的物质的量浓度.
×100%,混合溶液中溶质的质量应是两种NaCl溶液中NaCl的质量之和,求出w/(NaCl)后,又巳知混合溶液的密度,则可求混合溶液中NaCl的物质的量浓度.
解:(1)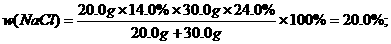
(2) 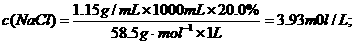
(3)设1000g水中加入NaCl的物质的量为x,则
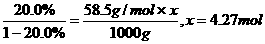 .
.
答:略.
Ⅲ 一定物质的量浓度溶液的稀释(浓缩、混合)
(1)计算原理:溶液稀释前后,溶质的质量或物质的量不变,即稀释定律.
(2)应用公式:
c1V1=c2V2或m1·a%=m2·b%,
c(混合后)=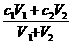 或m1·a%+m2·b%=(m1+m2)·c%.
或m1·a%+m2·b%=(m1+m2)·c%.
[注意]当溶液混合后密度未告知或混合前两种溶液浓度相差不大时,可近似认为混合后总体积等于混合前两种溶液的体积之和.
例如:配制250mL 1 mol/L HCl溶液,需要12mol/L HCl溶液的体积是多少?
(分析) 在用水稀释浓溶液时,溶液的体积发生了变化,但溶液中溶质的物质的量不变.即在浓溶液稀释前后,溶液中溶质的物质的量是相等的.
解:设配制250 mL(V1)1 mol/L(c1)HCl溶液,需要12 mol/L(c2)HCl溶液的体积为V2.
V2=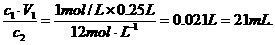
答:配制250mL 1 mol/L HCl溶液,需要12mol/L HCl溶液21 mL.
[注意]溶液在稀释或浓缩前后,若溶质没有损失,溶液中溶质的物质的量和质量都不变,但溶液的体积、密度和质量都发生了变化.
又如:将100mL 0.3 mol/L Na2SO4溶液和50 mL 0.2 mol/L Al2(SO4)3溶液混合后,溶液中SO2-4的物质的量浓度为 ( )
A.0.20 mol/L B.0.25 mol/L
C.0.40 mol/L D.0.50 mol/L
(分析) 两种溶液混合时,如果不考虑溶液体积的变化,其混合后溶液的体积就是两种溶液的体积之和,已知Na2SO4溶液的体积和浓度及Al2(SO4)3溶液的体积和浓度,就可以由n=c·V,求出Na2SO4和Al2(SO4)3的物质的量,再由Na2SO4和Al2(SO4)3的电离方程式可知两种溶液中SO2-4的物质的量,从而进一步计算出混合溶液中SO2-4的物质的量浓度.n(Na2SO4)=0.3 mol/L×0.1 L=0.03 mol,因为
1 mol Na2SO4电离出1 mol SO2-4,所以100 mL Na2SO4溶液中含SO2-4 0.03 mol.n[Al2(SO4)3]=0.2mol/L×0.05 L=0.01 mol.因为1 mol Al2(SO4)3电离出2 mol Al3+和3 mol SO2-4,所以50 mL Al2(SO4)3溶液中含SO2-4 0.03mol.故有:
c(SO2-4)=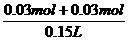 =0.40mol/L.
=0.40mol/L.
答案:C
[说明] ①电解质在溶液中的各微粒浓度不一定等于该电解质本身的浓度,因为电解质在溶液中要电离.
②两种不起反应、浓度又相差不大的两种溶液相混合时,混合溶液的总体积可看成是两种溶液的体积之和.
再如:要配制2.5 mol/L 硫酸溶液100 mL:
(1)需用4 mol/L 硫酸溶液_____mL.
(2)需用4mol/L 硫酸溶液_____mL与1 mol/L硫酸溶液______mL相混合配制.
(3)需用40%硫酸溶液(ρ=1.3g/cm3)______mL.
(4)如果采取浓、稀溶液相混合配制,需用40%硫酸溶液(ρ=1.3 g/cm3) ______mL,10%硫酸溶液(ρ=1.07 g/cm3)_______mL.
(5)采取蒸发溶剂法配制,若用10%硫酸溶液300mL配制,需蒸发_______水.
(分析) (1)由c1·V1=c2·V2,
得4 mol/L×V1=2.5 mol/L×100 mL,
所以V1mL=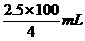 =62.5 mL.
=62.5 mL.
(2)设需用4 mol/L硫酸溶液的体积为x,则需用1 mol/L硫酸溶液的体积为(100 mL-x).
由(4 mol/L·x)+1 mol/L×(100 mL-x)=2.5 mol/L×l00 mL,
得x=50mL,即4 mol/L和1 mol/L硫酸溶液各50 mL.
(3)因为40%硫酸(ρ=1.3 g/cm3)的物质的量浓度是:
cB=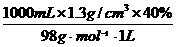 =5.31 mol/L,
=5.31 mol/L,
那么5.31 mol/L×V=2.5 mol/L×100 mL,
V=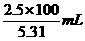 =47.1mL.
=47.1mL.
(4)设需用40%硫酸溶液的体积为x,则需10%硫酸溶液的体积为(100 mL-x),那么
(x×1.3g/cm3×40%)+(100 mL-x)×1.07 g/cm3×10%
=2.5 mol/L×0.1 L×98g/mol,
x=33.4 mL,100 mL-x=66.6 mL.
(5)10%硫酸(ρ=1.07 g/cm3)溶液的物质的量浓度为:
c(H2SO4)=
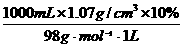 =1.09 mol/L,
=1.09 mol/L,
设10%硫酸(ρ=1.07 g/cm3)溶液需蒸发掉水的体积为x,那么
0.200 mol H2S在标准状况下的体积为
V(H2S)=n(H2S)·Vm=0.200 mol×22.4 L/mol=4.48L.
答:溶解的H2S在标准状况下的体积为4.48 L.
还如:Al2(SO4)3易溶于水,在水中发生如下电离:
Al2(SO4)3 2Al3++3SO2-4
已知500mLAl2(SO4)3溶液中溶有6,48g Al3+,求该溶液中SO2-4的物质的量浓度.
(分析) Al2(SO4)3 2Al3+ + 3SO2-4
2×27g 3 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com