
题目列表(包括答案和解析)
29.为了除去ZnCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再 加入适量盐酸,最好选的试剂( )
A.NH3·H2O B.NaOH C.Na2CO3 D.ZnCO3
28.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(括号内),溶液能与原来溶液完全一样的是( )

A.CuCl2 [CuSO4] B.NaOH [NaOH] C.NaCl [HCl] D.CuSO4 [Cu(OH)2]
27.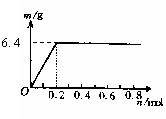 用Pt电极电解含有X3+和0.1molCu2+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)关系如图所示,则离子的氧化能力由大到小排列正确的是( )
用Pt电极电解含有X3+和0.1molCu2+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)关系如图所示,则离子的氧化能力由大到小排列正确的是( )
A.Cu2+>H+>X3+ B. H+>X3+>Cu2+
C.X3+>H+>Cu2+ D. Cu2+>X3+>H+www .ks 5u. co m
26.有关AgCl沉淀溶解平衡说法正确的是( )
A.AgCl难溶于水,溶液中没有Ag+ 和Cl-
B.升高温度,AgCl沉淀的溶解度减小
C.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
D.向存在AgCl沉淀溶解平衡的体系中加入NaCl固体,其中AgCl沉淀的溶解度不变
25.在如右图所示的装置中,a、b都是惰性电极,通电一段时间后,b极附近的溶液首先变红,则下列说法正确的是( )
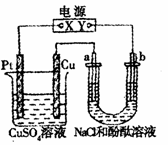 A.X是正极,Y是负极,CuSO4溶液的pH逐渐变小
A.X是正极,Y是负极,CuSO4溶液的pH逐渐变小
B.X是正极,Y是负极,CuSO4溶液的pH保持不变
C.X是负极,Y是正极,CuSO4溶液的pH逐渐变小
D.X是负极,Y是正极,CuSO4溶液的pH保持不变
23.下列关于电解质溶液的叙述正确的是 ( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子的物质的量浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.某氢氧化钠溶液跟醋酸溶液混合后溶液呈酸性,则混合溶液中离子的物质的量浓度之间的关系是c(H+)=c(CH3COO-)-c(Na+)+c(OH-)
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小
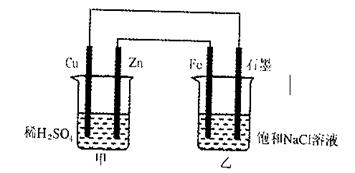 24.下图中甲、乙两个装置用导线连接,有关叙述正确的是( )
24.下图中甲、乙两个装置用导线连接,有关叙述正确的是( )
A.甲装置中Cu为阳极,乙装置Fe为负极
B.甲装置中SO2-4向Cu极移动,乙装置中的Na+向石墨极移动
C.乙烧杯中Fe极的电极反应式为:2H2O+2e-=2OH-+H2↑
D.当石墨电极上产生11.2L(标准状况)气体时,消耗Zn的质量为65g
22.下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
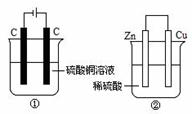 A.产生气体体积 ①=②
A.产生气体体积 ①=②
B.①中阴极质量增加,②中正极质量减小
C.电极反应式:
①中阳极:4OH- - 4e- = 2H2O+O2↑ ②中负极:2H++2e-=H2↑
D.溶液的pH变化:①减小,②增大
21.一定条件下,在体积为5L的密闭容器中,1mol X和1 mol Y发生以下反应:X(g)+2Y(g) 2Z(g);△H>0。经60s达到平衡,生成0.6mol Z,下列说法正确的是( )
2Z(g);△H>0。经60s达到平衡,生成0.6mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol
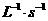
B.平衡后,再加l mol X.则Y的转化率减小
C.升高温度,X的浓度增大
D.将容器体积增大到10L,Z的平衡浓度变为原来的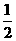
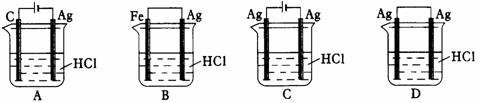
20.某同学为了使反应2HCl
+ 2Ag 2AgCl
+ H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )
2AgCl
+ H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )
19.用惰性电极电解200mL1.5mol/L的Na2SO4溶液,一段时间后,测得两极放出的气体体积之和为20.16L(标准状况),则在整个电解过程中转移的电子的物质的量为 (
)
(
)
A.0.6mol B.1.2mol C.1.4mol D.1.6mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com