
题目列表(包括答案和解析)
17.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题: (1)该反应的化学平衡常数表达式为K= ; (2)该反应为 反应(选填吸热、放热); (3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 ℃;
(4)830℃时,向该容器中加入1L CO2与1L H2 ,平衡时CO2的体积分数是 。
(1)写出白色固体转化黑色固体的化学方程式: ;
(2)白色固体转化成黑色固体的原因是: 。
16. 在25℃、101KPa时,____________________________时所放出的热量,叫做该反应的燃烧热。在25℃、101KPa时,1g乙醇完全燃烧生成CO2和液态水时放热29.713kJ,则能表示乙醇燃烧热的热化学方程式为_________________________________________。
14、某温度时,把1molN2O4气体通入体积为10L的真空容器,立即出现红棕色,反应进行4s时,NO2的浓度为0.04mol/L,再经过一段时间后,反应达平衡,这时容器内压强为开始时的1.8倍.则下列说法正确的是:
A、前4s中以N2O4的浓度变化表示的平均反应速率为0.01mol/L·s
B、在4s时容器内的压强为开始时的1.2倍
C、在平衡时容器内含N2O40.4mol
D、在平衡时容器内含NO21.6mol
第II卷(非选择题)
13.下列说法错误的是:
A、由于合成氨反应△H<0,△S>0,所以该反应能自发进行
B、将pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸所需加入的水多
C、溴水中有下列平衡:Br2+H2O HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
D、弱电解质在溶液中达到电离平衡后,加水稀释,平衡向电离的方向移动
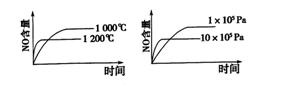
12.在0.lmol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH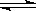 CH3COO-+H+
CH3COO-+H+
对于该平衡,下列叙述正确的是( )
A 加入少量NaOH固体,平衡向逆反应方向移动
B 加水,反应速率加快,平衡向逆反应方向移动
C 滴加少量0.lmol/L HCl溶液,溶液中[H+]减少
D 加入少量CH3COONa固体,平衡向逆反应方向移动
11、汽车的启动电源常用铅蓄电池。放电时的电池反应如下:
 PbO2 + Pb + 2H2SO4
2PbSO4↓+ 2H2O,根据此反应判断下列叙述中正确的是( )
PbO2 + Pb + 2H2SO4
2PbSO4↓+ 2H2O,根据此反应判断下列叙述中正确的是( )
A.PbO2是电池的负极
 B.负极的电极反应式为:Pb + SO
B.负极的电极反应式为:Pb + SO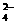 - 2e- PbSO4↓
- 2e- PbSO4↓
C.PbO2得电子,被氧化
 D.电池放电时,溶液酸性增强
D.电池放电时,溶液酸性增强
10.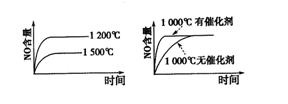
 已知:4NH3 (g)+5 O2 (g)
已知:4NH3 (g)+5 O2 (g) 4NO
(g)+6 H2O
(g);该反应是一个可逆反应,正反应是放热反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO
(g)+6 H2O
(g);该反应是一个可逆反应,正反应是放热反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A B C D
9.下列说法正确的是 ( )
A、90℃时,纯水的pH等于7
B、已知一种c (H+)=1×10-3mol/L的酸和一种c (OH-)=1×10-3mol/L碱溶液以等体积混合后,溶液呈酸性,其原因是浓的弱酸和稀碱反应所致
C、配制FeCl3溶液,为了抑制水解,常加稀硫酸
D、在Na2S溶液中,离子浓度的关系是:c (Na+)>c (S2-)>c (HS-)>c (OH-)>c (H+)
8.在一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)
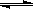 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( )
①C的生成速率是B的生成速率的2/3倍 ②单位时间生成a mol A,同时生成3a mo1B ③A、B、C的浓度不再变化 ④混合气体的总压强不再变化
⑤混合气体的物质的量不再变化 ⑥单位时间消耗 a mol A,同时生成3amolB
⑦A、B、C 的分子数目比为1∶3∶2
A.②⑦ B.⑥④ C.①③ D.⑤⑥
7.在水电离出的c(H+)=1×10-12 mol/L条件下,下列各组离子一定不能大量共存的是 ( )
A.NH+ 4、NO- 3、Cl-、Na+ B.K+、SO2- 3、Cl-、NO- 3
C.Na+、SO2- 4、Cl-、HCO 3- D. Na+、NO- 3、K+、SO2- 4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com