
题目列表(包括答案和解析)
4.维生素C具有的性质是( )
A.难溶于水 B.强还原性 C.强氧化性 D. 加热难分解
3.蛋白质发生的下列过程中,可逆的是( )
A.变性 B.煮熟 C.盐析 D. 加入浓硫酸
2.下列家庭化学小实验不能达到预期目的的是( )
A.用米汤检验食用加碘盐(含KIO3)中含有碘
B.用醋、石灰水验证蛋壳中含有碳酸盐
C.用碘酒检验汽油中是否含有不饱和烃
D.用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验
1.下列有关蛋白质的叙述中,不正确的是( )
A.蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解
B.人工合成的具有生命活性的蛋白质-结晶牛胰岛素,是1965年我国科学家最先合成的
C.重金属盐能使蛋白质变性,所以误食重金属盐会中毒
D.浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应
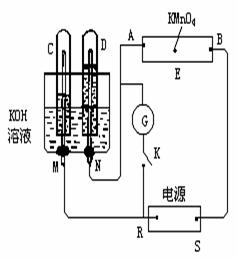
25、(10分)如图所示,E为沾有Na2SO4溶液的滤纸。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多孔的惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生。
(1)外电源的正、负极分别是R为_ 极,
S为_ 极。
(2)M极发生的电极反应式为___ ____,
B极发生的电极反应式为 ______。
(3)滤纸上的紫色点向哪方移动__ __(填A或B)。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要因为___
。
24、(12分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀H2SO425.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1) 该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用稀H2SO4溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在碱式滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
① 滴定操作的正确顺序是(用序号填写):E、 、D、B、 、 、 。
② 该滴定操作中应选用的指示剂是: 。
③ 在G操作中如何确定终点? 。
(2) 下列操作不能引起误差的是 :
①开始时仰视读数,终点时俯视读数;②注入酸液前锥形瓶内壁有少量水珠附着
③酸式滴定管尖嘴处开始有气泡,终点时无气泡;④碱式滴定管用蒸馏水润洗后,未用标准液润洗。
(3) 计算待测硫酸(稀释前的硫酸)溶液物质的量浓度为 mol/L
23、(3分)在一定条件下,反应2HI(g)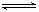 H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深(I2有颜色),可采取的措施是:
H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深(I2有颜色),可采取的措施是:
①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积
⑤增大HI的浓度 ⑥减小压强 ⑦加催化剂
22、(6分)今有①CH3COOH、②HCl、③H2SO4 三种溶液,用序号回答下列问题
(1)当它们的物质的量浓度相同时,其pH的由大到小排列是___________________。
(2)当它们pH相同时,其物质的量浓度的由大到小排列是_____________________。
(3)中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为 _________________。
21、(3分)根据下列2个热化学反应方程式:
FeO(s)+CO(g)= Fe(s)+ CO2(g) △H= ―218kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
20、(6分)(1)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体,写出固体转化的化学方程式:
_____。
(2)已知Ksp(AgCl)=1.8×10-10、Ksp(AgBr)=5.0×10-13、Ksp(AgI)=8.3×10-17。向物质的量浓度均为0.10mol/L的NaCl、NaBr、NaI的混合溶液中逐滴滴入硝酸银溶液,生成的沉淀的先后顺序是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com