
题目列表(包括答案和解析)
6.北京2008奥运会金牌直径为70mm,厚6mm。某化学兴趣小组对金牌成分提出猜想:
甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌
合金)制成。为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
5.1989年,世界卫生组织把铝确定为食品污染源,下列铝的应用应该加以控制的是
A. 制铝合金 B. 制电线 C. 制防锈油漆 D. 制易拉罐
4.科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中错误的是
A.自然界硅的贮量丰富 B.自然界中存在大量的单质硅
C.高纯度的硅被用于制作计算机芯片 D.光导纤维的主要成分是SiO2
3.上海世博园地区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾
的困扰。你估计这一空气污染物可能是因为含有
A.FeO粉尘 B.P2O5粉尘 C.Fe2O3粉尘 D.SiO2粉尘
2.下列具有特殊性能的材料中,全部由非金属元素形成的化合物是
A. 透明陶瓷材料硒化锌 B. 氧化铝陶瓷(人造刚玉)
C. 超硬物质氮化硅陶瓷 D. 超导材料K3C60
1.下列说法正确的是
①水银不是银 ②干冰不是冰 ③铅笔不含铅 ④金刚石不含金
A. ①④ B. ② C. ②③ D. ①②③④
26、(8分)一般情况下,当人体一次性摄取300mg-500mg亚硝酸钠时,就会引起中毒。某研究小组用碘量法测定泡菜中亚硝酸盐的含量。有关反应如下:
2NaNO2 + 2H2SO4 +2KI = K2SO4 + I2 + 2H2O+ Na 2SO4 +2NO
I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6
取1kg泡菜,榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的亚硝酸盐都成为要硝酸钠。在过滤后的滤液中加入氢氧化铝乳液,以除去色素。再次过滤后得到滤液,将该滤液稀释至1L,取25.00mL稀释后的滤液与过量的稀硫酸和碘化钾溶液反应,在选用合适的指示剂,用0.05000mol·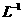
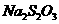 标准溶液进行滴定。实验数据记录如下;
标准溶液进行滴定。实验数据记录如下;
|
滴定次数 |
0.05000mol·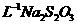 标准溶液体积/mL 标准溶液体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
|
|
1 |
0.00 |
20.04 |
|
2 |
0.12 |
20.08 |
|
3 |
0.05 |
20.05 |
请回答下列问题:
(1)该实验中可选用的指示剂是 ,滴定终点的现象是 。
(2)有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻亚硝酸盐的危害。这主要是因为橙汁中含有丰富的维生素C,维生素C具有 性(填“氧化性”或“还原性”)
(3)通过计算判断若某人一次食入0.125kg这种泡菜,是否会引起中毒?
25、 (10分)二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:
(10分)二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:
 2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):
2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):
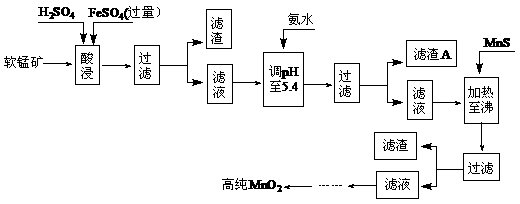










 某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
|
沉淀物 |
CuS |
ZnS |
MnS |
FeS |
|
|
|
Ksp |
8.5×10-45 |
1.2×10-23 |
1.4×10-15 |
3.7×10-14 |
|
|
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要化学方程式为:
 。
。
 (2)滤渣A的主要成分为
。
(2)滤渣A的主要成分为
。 (3)加入MnS的目的是除去
杂质。
(3)加入MnS的目的是除去
杂质。
 (4)碱性锌锰电池中,MnO2参与的电极反应式为
。
(4)碱性锌锰电池中,MnO2参与的电极反应式为
。
 (5)从废旧碱性锌锰电池中可回收利用的物质有
(写两种)
(5)从废旧碱性锌锰电池中可回收利用的物质有
(写两种)
24、(12分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请在右边方框内画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 负极反应
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢腐蚀。
有关反应的化学方程式
劣质不锈钢腐蚀的实验现象
23、(8分)⑴现有0.1mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是 。纯碱溶液呈碱性的原因(用离子方程式表示)是 ,该溶液pH的范围一定介于 之间。
⑵为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com