
题目列表(包括答案和解析)
1.下列做法正确的是( )
A.为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠
B.为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂
C.食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿
D.为保证人体所需足够蛋白质我们要多吃肉,少吃蔬菜和水果.
24.(14分)在一个固定体积为1L的密闭容器内,已知A和B的起始浓度分别为6 mol•L-1和
7
mol•L-1,发生如下反应:2A(g)+3B(g) 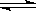 xC(g)+ D(g),2min后反应达到平衡,C的反应速率为2 mol•L-1•min-1,平衡时D的浓度为2 mol•L-1。求:K^S*5U.C#O%
xC(g)+ D(g),2min后反应达到平衡,C的反应速率为2 mol•L-1•min-1,平衡时D的浓度为2 mol•L-1。求:K^S*5U.C#O%
(1)x的值= ; (2)平衡常数K= ;
(3)A的转化率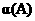 =
;
(4)B的反应速率为
;
=
;
(4)B的反应速率为
;
(5)若使体系温度升高,平衡时容器内气体分子数增多,则正反应为 (填“吸热”或“放热”)反应;平衡常数K (填“增大”、“减小”或“不变”。)
(6)保持温度不变,如果在该密闭容器中充入A、B、C、D的起始浓度分别为:
c(A)=3 mol•L-1, c(B)=1 mol•L-1, c(C)=3 mol•L-1, c(D)=3 mol•L-1。
此时该反应是否达到平衡状态? 。若要达到平衡状态,反应应向 方向进行,因为 。
长乐二中2009-2010学年第二学期期中考试卷
23.(14分)2009年12月,联合国气候变化大会在丹麦哥本哈根举行。过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可以利用的资源,其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH)。其化学方程式为:K^S*5U.C#O%

请填空:
(1)写出上述反应的平衡常数表达式K=___________________________。
(2)在容积为2 L的密闭容器中,用一定量二氧化碳与一定量氢气在一定条件下合成甲醇,实验结果如下图所示。下列说法正确的是(填序号)____________
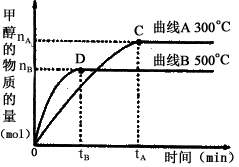
A.在300℃,从反应开始到平衡,甲醇的平均反应速率为: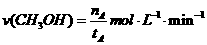
B.反应体系从300℃升温到500℃,平衡常数K变大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升温到500℃,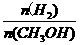 增大
增大
(3)25℃,1.01×10 Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9
kJ热量,此反应的热化学方程式为_______________________________________________。
Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9
kJ热量,此反应的热化学方程式为_______________________________________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是_________________________,正极的电极方程式为_______________________________
22.(17分)如图所示,甲、乙两池的电极材料都是铁棒与碳棒,请回答下列问题:K^S*5U.C#O%
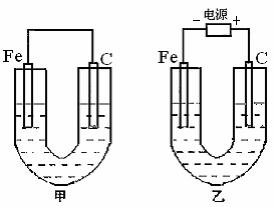
(1)把化学能转化为电能的装置是 (填“甲”或“乙”)。
(2)①若两池中均盛有CuSO4溶液,反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②乙池中碳极上电极反应式是 。
(3)若两池中均盛有饱和NaCl溶液,
①写出乙池中总反应的化学方程式为 ,
②若将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变 ,发生此现象的离子方程式为 ;
若往乙池中滴入酚酞试液,
(填铁或碳)棒附近呈现红色
③若乙池中通过0.02mol 电子后停止实验,反应后池中溶液体积是200mL,溶液混匀后的c(OH-)为 。
21.(5分)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,则其热化学方程式为: 。又已知H2O(l)=H2O(g);ΔH=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 kJ。
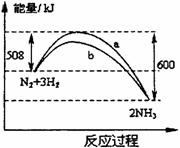
20.一个化学反应一般都有旧化学键的破坏和新化学键的形成。在一定条件下,氮气与氢气合成氨气的能量变化的曲线如右图(a是没有使用催化剂的反应历程,b是使用了催化剂的反应历程),下列叙述正确的是( )
① 使用催化剂可降低生产能耗
② 该反应的热化学方程式为N2(g)+3H2(g)
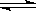 2NH3(g) △H=-92kJ•mol-1
2NH3(g) △H=-92kJ•mol-1
③ 相同状况下,lmol氮气和3mol氢气总能量高于2mol氨气的总能量
④ 相同状况下,lmol氮气和3mol氢气总键能低于2mol氨气的总键能
A.只有②③ B.只有②③④ C.只有①②③ D.①②③④
19. 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2 -e- + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
18.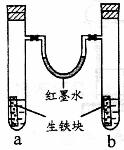 右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和醋酸溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )
右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和醋酸溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )
A.生铁块中的碳是原电池的正极
B.两试管中相同的电极反应式是:Fe -2e-= Fe2+
C.红墨水柱两边的液面变为左低右高
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
17.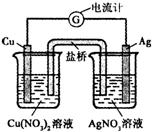 某原电池构造如右图所示。下列有关叙述正确的是( )
某原电池构造如右图所示。下列有关叙述正确的是( )
A.在外电路中,电子由银电极流向铜电极
B.取出盐桥后,电流计的指针仍发生偏转
C.外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D.原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2
16.可逆反应2NO2(g)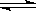 N2O4(g)
在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
N2O4(g)
在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
① 单位时间内生成n mo1 N2O4的同时生成2n mol NO2
② 单位时间内生成n mol N2O4的同时消耗2n mol NO2
③ 混合气体的颜色不再改变
④ 混合气体的密度不再改变的状态
⑤ 混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com