
题目列表(包括答案和解析)
8. 关于硫原子核外电子的叙述错误的是( )
A.排布在K、L、M三个电子层上 B.3p亚层上有2个空轨道
C.共有16种不同的运动状态 D.共有5种不同能量的电子
7.下列说法正确的是 ( )
A. 决定原子种类的微粒是质子
B. 氢的三种同位素:H、D、T,氯有两种同位素: 35Cl、37Cl;当组成氯化氢分子时,
其分子量所得的数值最多有6种
C. 若某元素原子的质量是ag,12C原子的质量为bg, 则该原子的相对原子质量是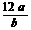
D. 铷有两种同位素85Rb和87Rb, 已知铷元素的近似相对原子质量为85.5,
则85Rb 的质量百分含量是75%
6.0.4mol金属钠投入到足量的CH3CH2OD中,则生成的气体中含有 ( )
A.0.2mol中子 B.0.4mol电子 C.0.2mol质子 D.0.4mol分子
5.下列关于化学学习和研究的说法错误的是( )
A. 能量的变化一定会引起化学反应的变化
B. 化学反应一定会引起化学键的变化
C. 化学模型的建立有助于解释一些化学现象
D. 化学基本原理的应用是建立在有一定条件的基础上的
4.下列各组物质的分类,正确的是( )
A.同位素:金刚石、石墨 B.非极性分子:H2O、NH3
C.同系物: -OH、
-OH、 -CH2OH D.同分异构体:HCOOCH3、HOCH2CHO
-CH2OH D.同分异构体:HCOOCH3、HOCH2CHO
3.被誉为“光纤之父”的华人科学家高锟荣获2009年诺贝尔化学奖。
下列叙述错误的是( )
A.SiO2是生产光导纤维的主要原料
B.SiO2与CO2(干冰)的晶体结构不同
C.干冰和SiO2固体熔化时破坏的作用力是相同的
D.二氧化硅晶体中不存在SiO2分子,因为它含有类似金刚石的空间网状结构
2.下列有关表达正确的是( )
A.硫离子的电子排布式:1s22s22p63s23p4
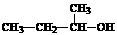 B.N原子最外层电子的轨道表示式:
B.N原子最外层电子的轨道表示式:
C.CO2分子的结构式: O=C=O
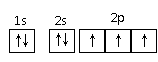
D.2-甲基-1-丙醇的结构简式:
1.我国决定推广使用车用乙醇汽油,它是在汽油中加入适量的乙醇形成的混合燃料。
下列叙述错误的 ( )
A.使用乙醇汽油能减少有害气体的排放
B.乙醇汽油是一种新型化合物
C.燃料中的乙醇可以通过粮食发酵或化工合成等方法制得
 D.乙醇汽油的推广使用可以缓解石油资源短缺对经济发展造成的压力
D.乙醇汽油的推广使用可以缓解石油资源短缺对经济发展造成的压力
19.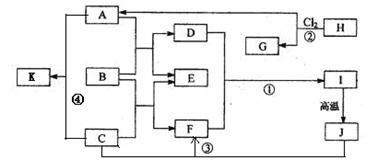 (7分)下图中B为日常生活中常见的金属,E是一种新型的清洁能源,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料, K是生理盐水主要成分(图中部分反应物或生成物没有列出)。
(7分)下图中B为日常生活中常见的金属,E是一种新型的清洁能源,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料, K是生理盐水主要成分(图中部分反应物或生成物没有列出)。
请按要求回答:
⑴ 写出B在周期表的位置第_____周期_____族,G的电子式_________________。
⑵ 反应①的离子方程式为_______________________________________。
⑶ 反应②进行的条件是___________________,_____________________。
⑷ 反应③的化学方程式为________________________________________。
20(10分)请根据下面是八种有机化合物的转换关系回答下列问题:
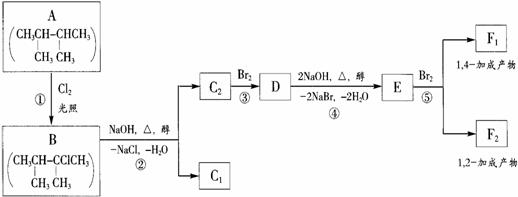
(1)根据系统命名法,化合物A的名称是 。
(2)上述框图中,①是 反应,③是 反应。(填反应类别)
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式
。
(4)C2的结构简式是 。F1的结构简式是 。
F1和F2互为 。
(5)上述八个化合物中,属于二烯烃的是 。二烯烃的通式是 。
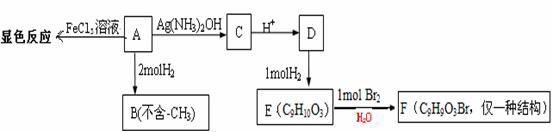 21(9分)1mol
物质A有如下合成路线:
21(9分)1mol
物质A有如下合成路线:
(1)A的分子式为 ,含有的官能团为 (写名称)。
(2)A→C的化学方程式为 ,反应类型为 。
(3)H、G与B互为同分异构,且满足下列条件:
①H、G与浓溴水和NaHCO3都不反应,且结构中均不含有-CH3(官能团不能同时连在同一个碳原子上)。
②1molH、G 都能与2molNa反应。③H环上一氯取代只有2种,G环上一氯取代只有3种。
H的结构简式 ,G的结构简式 。
(4)已知在一定条件下R1CH=CHR2→R1CHO+ R2CHO,A在一定条件下氧化生成羧酸X、Y。X是芳香族化合物,Y是一种还原性的二元羧酸。写出X在浓硫酸条件下的缩聚反应 。
22(8分)观察并分析下列图示,按要求填空:
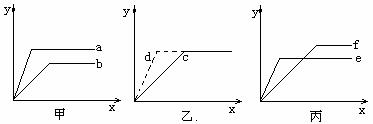
(1)若甲、乙、丙中的x轴都表示时间,y轴都表示产生气体的体积(相同条件下)。
① 若把等质量的钠和钾分别加入足量的水中,产生氢气的体积与时间的关系符合图示
(填“甲”、“乙”或“丙”),其中曲线 (填“a、b 、c……”)表示的是钾。
② 若把等质量的碳酸钠和碳酸氢钠分别加入足量等浓度等体积的盐酸中,产生CO2气体体积与时间的关系符合图示 (填“甲”、“乙”或“丙”),其中曲线 (填“a、b 、c……”)表示的是碳酸钠。
③ 若向足量的2mol/L的盐酸中分别投入镁条和铝片,产生氢气的体积与时间的关系如图示乙,则加入的镁和铝的质量之比是 。
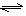 (2)对于可逆反应:A(g)+2B(g) nC(g)+D(s) △H<0;若甲、乙、丙中的x轴都表示时间,y轴都表示反应物A的转化率。
(2)对于可逆反应:A(g)+2B(g) nC(g)+D(s) △H<0;若甲、乙、丙中的x轴都表示时间,y轴都表示反应物A的转化率。
①图示 (填“甲”、“乙”或“丙”)可表示不同温度下,A的转化率随时间变化的关系;
②若图示甲表示不同压强下:A的转化率随时间变化的关系,则可推知n的数值是 ;
16.(3分)现代化学教育强调“以人为本”,安全教育是实验的重要内容。下列操作不会发生安全事故的是 。
①闻氯气的气味时,用手轻轻在瓶口扇动,仅使少量的氯气飘进鼻孔
②用聚氯乙烯塑料袋包装食品
③实验室用剩的钠、钾又放回到原试剂瓶中。
④在试管内做钾与水反应的实验
⑤为了节约药品,锌与稀硫酸反应一开始,就做点燃实验
⑥在密闭的容器中在镁光灯的照射下做氯气和甲烷取代反应实验
⑦检验SO42-时,先加入盐酸,后加入氯化钡溶液
17(10分)某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca.Al.Fe三
种元素。因茶叶中Ca.Al.Fe元素含量较低,所以实验时称取茶叶10 g查阅资料:
(1)草酸铵[(NH4)2C2O4]溶解度不大,为弱电解质。
(2)茶叶中的钙、铝、铁三种元素在空气中灼烧后转化成CaO、Al2O3、Fe2O3
(3)Ca2+、Al3+、Fe3+完全转化为氢氧化物沉淀的pH为:Ca(OH)2;pH≥13; Fe(OH)3; pH≥4.1
Al(OH)3;pH≥6.5
(4)在微酸性溶液中,Al3+与铝试剂[(NH4)3C19H11O3(COO)3]反应,生成玫瑰红色物质.
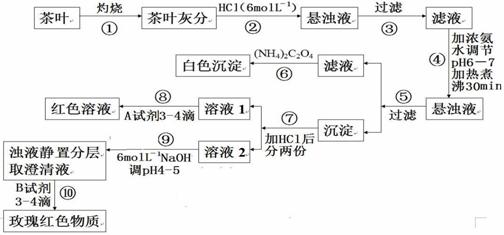
根据上述过程或信息填空:
(1)过滤所需要的玻璃仪器有:______________ ,_______________ ,_____________ 。
(2)步骤④用氨水调pH,可否用比较浓的烧碱溶液代替氨水? ;
原因是: 。
(3)写出检验Ca2+的离子方程式为: 。
(4)写出第⑤步得沉淀所含主要物质的化学式: 。
(5)写出步骤⑧的离子方程式: 。
(6)步骤⑨的目的是: ;猜测步骤⑩的目的是: 。
18(8分)小明同学在某食品包装袋中发现一小袋“脱酸素剂”,打开封口,将其倒在滤纸上,仔细观察,袋内物质为灰黑色粉末,还有少量的红色粉末。为了探究其主要成分,小明和学校兴趣小组的其他同学一起开展了研究。
首先,甲同学查阅了有关资料,找到其配方主要有如下几种:①4g还原铁粉、2g活性炭、1g氯化钠;②400g还原铁粉、300g氧化钙、30g氯化钠;③400g还原铁粉、150g硅胶(不溶于水和酸)、30g氯化钠;之后,小组同学分别进行如下讨论和实验探究:
(1)针对每种配方中“还原铁粉”的作用,大家展开讨论。若你也是小组中一员,请给出合理的理由: ;并设计一个最简单的方法分离出样品中的还原铁粉: 。
(2)乙同学针对其中的红色物质提出猜想,认为可能是 (填化学式),并设计了实验方案一:取少量上述已分离出还原铁粉后的样品,溶于足量稀硫酸后,充分搅拌并过滤,再向滤液中加入足量NaOH溶液得到红褐色沉淀。写出有关反应的化学方程式:
;
(3)配方①中用到活性炭除了起吸附的作用外还可能起到的作用是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com