
题目列表(包括答案和解析)
6. 某原电池总反应方程式为:2Fe3+ +Fe = 3 Fe2+,能实现该反应的原电池组成为:( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
5.下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是:
A.化学反应速率理论可指导怎样提高原料的转化率
B.化学平衡理论可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样在一定时间内快出产品
D.正确利用化学反应速率和化学平衡理论都可以提高化工生产的综合经济效益
4. 用铂电极电解Cu(NO3)2和NaCl的混合溶液,最初一段时间阴极和阳极上析
出的物质分别是:( )
A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2
3. 在700K时,反应SO2(g)+1/2O2(g) SO3(g) 的平
SO3(g) 的平 衡常数为K,则相同温度下反应2SO3(g)
衡常数为K,则相同温度下反应2SO3(g) 2SO2(g) + O2(g)的平衡常数为( )
2SO2(g) + O2(g)的平衡常数为( )
A.(1/K)2 B.K2 C.1/K D.(K)-1/2
2. 下列说法中正确的是 ( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.熵增加且放热的反应一定是自发反应
D.非自发反应在任何条件下都不能实现
1. 2L的密闭容 器中进行如下反应:N2
+ 3H2
器中进行如下反应:N2
+ 3H2  2NH3,在5s内N2减少了0.8mol,则该5s内NH3的平均反应速率是( )
2NH3,在5s内N2减少了0.8mol,则该5s内NH3的平均反应速率是( )
A.0.24 mol/(L·s) B.0.16mol/(L·s)
C.0.08 mol/(L·s) D.0.32 mol/(L·s)
29.(8分)有两只密闭容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应:2SO2+O2 2SO3,并达到平衡。则(填>、=、<;正、逆;增大、减小、不变)
2SO3,并达到平衡。则(填>、=、<;正、逆;增大、减小、不变)
 ⑴达到平衡所需要的时间:t(A) t(B),SO2的转化率:a(A) a
(B)
⑴达到平衡所需要的时间:t(A) t(B),SO2的转化率:a(A) a
(B)
⑵起始时两容器中的反应速率:v(A) v(B),反应过程中的反应速率:v(A) v(B)。
⑶达到平衡时,在两容器中分别通入等量的Ar气。A中的化学平衡向 反应方向移动,B中的化学反应速率 。
⑷达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的质量分数 ,B容器中SO2的质量分数 。
厦门大学附属科技中学2009-2010学年第二学期期中考试
28.(7分)将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应:
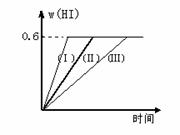
I2(g) + H2(g)  2HI(g);放热反应,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:(1)达平衡时,I2(g)的物质的量浓度为
。
2HI(g);放热反应,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:(1)达平衡时,I2(g)的物质的量浓度为
。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是  ,则乙条件可能是
。(填序号)
,则乙条件可能是
。(填序号)
① 恒容条件下,升高温度; ② 恒容条件下,降低温度;
 ③
恒温条件下,缩小反应容器体积;④ 恒温条件下,扩大反应容器体积;
③
恒温条件下,缩小反应容器体积;④ 恒温条件下,扩大反应容器体积;
⑤ 恒温恒容条件下,加入适当催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b 、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,则a、b、c的关系
是
。K^S*5U.C#O%
、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,则a、b、c的关系
是
。K^S*5U.C#O%
27.(9分)恒温恒容下,将2 molA气体和2 molB气体通人体积为2 L的密闭容器中发生如下反应:2A(g)+B(g) x C(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2
mo1·L-1。
x C(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2
mo1·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x = 。K^S*5U.C#O%
(3)A的转化率与B的转化率之比为  。
。
(4)下列各项可作为该反应达到平衡状态的标志的是 。
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分于质量不再变化 D.A的消耗速率与B的消耗速率之比为2∶1
(5)保持温度和容积不变,向平衡体系中再充人2molA和2molB气体,达到新平衡时B的物质的量为 。
(6)欲使反应达到平衡时,C的物质的量分数与上述平衡相等,起始加入A、B的物质的量n(A)和n(B)之间应满足的关系为 。
26.(8分)煤化工中常需研究不同温度下平衡常数、投料比及热值等问题
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是: 反应(选填:放热、吸热)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有
(选填A、B、C、D、E)
|
|
A |
B |
C |
D |
E |
|
n(CO2) |
3 |
1 |
0 |
1 |
1 |
n(H2)  |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g) 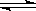 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) 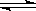 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)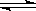 H2(g)+CO2(g)
平衡常数K2 ,
H2(g)+CO2(g)
平衡常数K2 ,
则K、K1、K2之间的关系是:

(4)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com