
题目列表(包括答案和解析)
4.下列物质在一定条件下,不能和氢气发生加成反应的是
A.乙醛 B.乙醇 C.苯酚 D.甲苯
3.下列产品的使用不会对环境造成污染的是
A.含磷洗衣粉 B.氟里昂 C.酒精 D.含大量甲醛的家具
2.下列微粒,不属于官能团的是
A.-CH3 B.-CHO C.-COOH D.-OH
1.用工业酒精不能勾兑白酒,这是因为其中含有一种有毒物质
A.CH3OH B.CH3COOH C.CH3COOCH2CH3 D. CH3CH2OH
30. (12分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
① Z的原子序数为29,其余的均为短周期主族元素;K^S*5U.C#
②Y原子价电子(外围电子)排布msnmpn ;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是 。该元素在周期表中的位置是 族。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。(填写序号)
a.稳定性:甲>乙,沸点:甲<乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(3)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
;1 mol该晶体中含有 mol的化学键
福建师大附中2009-2010学年第二学期模块测试卷
高二化学《物质结构与性质》

29.(11分)A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:
⑴ 写出A、C、E三种元素的符号:
A , C , E 。
⑵ 甲、乙两分子中含有非极性共价键的是 (填分子式),它的电子式为 。
⑶
C、D、F的离子中,半径最小的是
(填离子符号)
⑷ 在化合物BA4中元素B的杂化方式为: 杂化,BA4的空间构型为 。
⑸用氢键表示式写出液态D的氢化物中存在的氢键 
28.(6分)请回答下面问题
(1)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
|
氟化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/K |
1266 |
1534 |
183 |
解释表中氟化物熔点差异的原因:
。
(2)CO的结构可表示为C≡O,N2的结构可表示为N≡N。下表是两者的键能数据:(单位:kJ·mol-1)K^S*5U.C#
|
|
C-O |
C=O |
C≡O |
|
CO |
357.7 |
798.9 |
1071.9 |
|
|
N-N |
N=N |
N≡N |
|
N2 |
154.8 |
418.4 |
941.7 |
CO与N2的结构相似,分子中都含有共价三键,其中含有 个π键;结合数据说明CO比N2活泼的原因:
。
27.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,其分子结构如图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,则下列说法正确的是( )
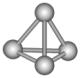 A.N4属于一种新型化合物
A.N4属于一种新型化合物
B.N4与N2互为同位素
C.N4沸点比P4(白磷)高
D.1molN4气体转变为N2将放出882kJ热量
26.下列关于晶体的叙述中,错误的是( )
A.每摩尔Si晶体中,含有2摩尔Si-Si共价键
B.在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子
C.在CsCl晶体中,与每个Cs+周围紧邻的有8个Cl-,而与每个Cs+等距离紧邻的也有8个Cs+
D.在简单立方堆积的金属晶体中,每个金属原子周围紧邻的有6个金属原子
25.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
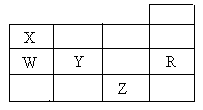 A.常压下五种元素的单质中,Z单质的沸点最高
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.Y元素的非金属性比W元素的非金属性强
D.W的氢化物的沸点比X的氢化物的沸点高K^S*5U.C#
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com