
题目列表(包括答案和解析)
7、既可以发生消去反应,又能被氧化成醛的物质是 ( )
A.2,3-二甲基-2-丁醇 B.2,2-二甲基-1-丁醇
C.2-甲基-2-丁醇 D. 2-甲基-1-丁醇
6、某化合物的分子式为C5H11Cl,分析数据表明:分子中有两个-CH3、两个-CH2-、
一个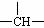 ,一个-Cl,它的可能的结构有 (
)
,一个-Cl,它的可能的结构有 (
)
A.2种 B. 3种 C.4种 D.5种
5、可用于区别苯酚、乙醇、氢氧化钠、硝酸银、硫氰化钾五种溶液的一种试剂是( )
A、浓溴水 B、石蕊试液 C、FeCl3溶液 D、FeCl2溶液
4、下列有关说法不正确的是
A、具有相同通式的有机物不一定互为同系物
B、分子组成相差一个或若干个CH2原子团的化合物一定互为同系物
C、分子式为C3H8与C6H14的两种有机物一定互为同系物
D、两个相邻同系物的相对分子质量数值一定相差14
3、仔细分析下列表格中烃的排列规律,判断排列在第12位的烃的分子式是( )
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
…… |
|
C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
…… |
A.C6H12 B.C6H14 C.C5H12 D.C5H10
2、下列有机物命名正确的是 ( )
A . 2,3,3-三甲基己烷 B . 1,2,3-三甲基丁烷
C . 2-乙基丁烷 D . 3,3-二甲基丁烷
1、下列商品的使用不能体现环保理念的是( )
A.无铅汽油 B.无磷洗涤剂 C.无氟冰箱 D.无碘食盐
例3:用NA表示阿伏加德罗常数,下列说法正确的是( )
A、0℃、1.01×105Pa时,22.4L SO3含有NA个分子
B、含有5.3gNa2CO3的溶液中,有0.05NA个CO32-离子
C、32gCu作还原剂时转移的电子数为NA或0.5NA
D、1mol FeCl3完全转化为氢氧化铁胶体后,胶体粒子数为NA
解析:因为标准状况下SO3为固体,不能用气体摩尔体积计算,故A不能;而CO32-在水中会发生水解,故含0.05mol碳酸钠的水溶液中,所含CO32-离子的物质的量应小于0.05mol,所以B 不对;铜在化学反应中可以呈+1价,(如铜和硫单质共热时生成Cu2S),1mol Cu失出1mol e-,也可以呈+2价,(如铜在氯气中燃烧生成CuCl2),1mol Cu失出2mol e-,故C正确;因为胶体粒子是许多分子的集合体,故1mol Fe(OH)3形成的胶体粒子数远小于NA,所以D错误。
答案:C
变式练习3:设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
A.1molCl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
解析:阿伏加德罗常数是微粒的集合体,其近似值为6.02×1023mol-1,常用符号NA来表示。化学微粒指的是分子、原子、离子、质子、中子、电子等微观粒子。
Fe过量可使Fe3+还原为Fe2+,故A不正确;3NO2+H2O==2HNO3+NO,易知B正确;C中, 可把N2O4看作2NO2,则有1moLNO2,所以有3mol原子;也可以用极端方法,看作全部NO2或全部N2O4考虑,也可得出结果。由方程式3Fe+4H2O===Fe3O4+4H2↑可知D不正确。
答案:B C
例2如果1个12C原子的实际质量为ng,R原子的相对质量为M,阿伏加德罗常数用NA表示,则1个R原子的实际质量为( )
A、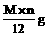 B、
B、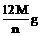
C、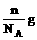 D、
D、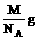
解析:R的相对原子质量为M,则其摩尔质量为M g/mol,即NA个R原子的质量为Mg,故1 个R原子的实际质量为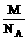 g。
g。
又依题意,1 个12C原子的质量为ng,1mol 12C原子的质量为12g,设1 个R原子的质量为yg,1molR原子的质量为Mg,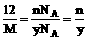 ,故y =
,故y = 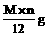 。
。
答案:AD
变式练习2:已知NH4HCO3 NH3+H2O+CO2↑,则150℃时NH4HCO3分解产生的混合气体A的密度是相同条件下H2密度的 倍。
NH3+H2O+CO2↑,则150℃时NH4HCO3分解产生的混合气体A的密度是相同条件下H2密度的 倍。
A.26.3 B.13.2
C.19.8 D.无法计算
解析:假设NH4HCO3为1 mol,则其质量为79 g ,完全分解产生的气体为3 mol ,故有:M混合气体=79g/3mol =26.3g/mol;又由“相同条件下,气体的密度比等于其摩尔质量比”,故混合气体A的密度是相同条件下H2密度的26.3/2 = 13.2倍。
答案:B
例1下列关于物质的量的叙述中,正确的是( )
A.1mol食盐含有6.02×1023个分子
B.Mg的摩尔质量为24
C.1mol水中含有2mol氢和1mol氧
D.1molNe含有6.02×1024个电子
解析: NaCl为离子化合物,其结构中无分子,且食盐为宏观物质,不可用mol来描述,故A不正确;Mg的摩尔质量为24g/mol,单位不对,故B不正确;C中对1mol水的组成的描述不正确,应为:1mol水中含有2mol氢原子和1mol氧原子;故答案为D。
答案:D
变式练习1:下列叙述中正确的是( )
A、镁的原子质量就是镁的相对原子质量
B、一个氧原子的实际质量约等于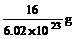
C、水的相对分子质量等于18g
D、二氧化硫的摩尔质量是64g
解析:相对原子质量是比值,不是原子的实际质量,故A不正确;1mol氧原子的实际质量是16g,故一个氧原子的质量为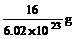 ,所以B正确;相对分子质量的单位是1,不是g,所以C错误;摩尔质量的单位为g·mol-1,所以D也是错的。
,所以B正确;相对分子质量的单位是1,不是g,所以C错误;摩尔质量的单位为g·mol-1,所以D也是错的。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com