
题目列表(包括答案和解析)
7.下列各组离子一定能大量共存的是 ( )
A.含有大量Fe3+的溶液中:NH4+、Na+、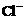 、
、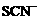
B.在强碱溶液中:Na+、K+、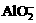 、
、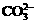 -
-
C.在c(H+)= 10-13mo1/L的溶液中:NH4+、A13+、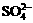 、
、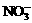
D.在pH=1的溶液中:K+、Fe2+、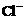 、
、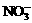
6.本题所列的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是 ( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
5.仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是 ( )
A.加热 B.加压 C.减少生成物浓度 D.加大反应物浓度
4.用铂电极电解CuSO4溶液,当铜离子浓度降至一半时,停止通电,若使CuSO4溶液恢复原浓度、原体积,应加入的适量适当物质是 ( ) A.CuSO4 B.CuSO4·5H2O C.CuO D.Cu(OH)2
3.在101kPa和25℃时,热化学方程式:H2(g) + 1/2O2(g) =H2O(g);△H=-241.8kJ/mol,H2(g) + 1/2O2(g) =H2O(1);△H=-285.8kJ/mol。下列说法中错误的是: ( )
A.H2燃烧生成1molH2O(g)时,放出241.8kJ的热量
B.H2的燃烧热为285.8kJ
C.O2 前面的1/2表示参加反应的O2的物质的量
D.1mol液态水变成水蒸气时吸收44kJ的热量
2.已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是 ( )
A.Q1<Q3<Q2 B.Ql<Q2<Q3 C.Q1<Q2=Q3 D.Q1=Q2=Q3
1.下列反应中,属于氧化还原反应同时又是吸热反应的是 ( ) A.Ba(OH)2·8H2O与NH4Cl反应 B.铝与稀盐酸反应 C.灼热的炭与CO2反应 D.甲烷与O2的燃烧反应
30.已知可逆反应:
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1, c(N)=2.4 mol·L-1; 达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)该温度下的平衡常数K= ;
(3)若反应温度不变,反应物的起始浓度为:c(M)= c(N)=b mol·L-1,达到平衡后,M的转化率多少?(计算过程)。
29. 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸
乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸 易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+
易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+
2Mn2++10CO2↑+8H2O
该组同学设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③
用浓度为0.1000 mo l/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;
l/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;
请回答:
⑴
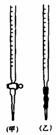
滴定时,将KMnO4标准液装在右图中的  (填“甲”或“乙”)滴定管中。
(填“甲”或“乙”)滴定管中。
⑵ 本实验滴定达到终点的标志可以是
⑶ 通过上述数据,计算出x= 。
(4) 若滴定终点时仰视滴定管刻度,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。
28.某温度(t℃)时,水的Kw=10-13 mol2·L-2,则该温度(填大于、小于或等于) 25℃,其理由是 。将此温度下pH=10的NaOH溶液aL与pH=2的H2SO4的溶液bL混合,则:
(1)若所得混合液为中性,则a∶b ;
(2)若所得混合液的pH=3,则a∶b ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com