
题目列表(包括答案和解析)
3.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 = 2Fe(OH)2。以下说法正确的是
A. 负极发生的反应为:Fe-2e- = Fe2+
B. 正极发生的反应为:2H2O+O2+2e- = 4OH-
C. 原电池是将电能转变为化学能的装置
D. 钢柱在水下部分比在空气与水交界处更容易腐蚀
2.下列分子中属于非极性分子的是
A. H2O B. CH4 C. NH3 D. HCl
1.下列说法正确的是
A. 活化分子相碰撞即可发生化学反应
B. 升高温度会加快化学反应速率,其原因是增加了活化分子的百分率
C. 某一反应的活化分子百分率是个定值
D. 浓度增大使得反应物分子中活化分子百分率增大
21.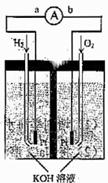 (10分) 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(10分) 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b表示)。
(2)负极反应式为 。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
 2LIH
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②根据反应Ⅰ用锂吸收224L(标准状况)H2,生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
(4)用以上燃料电池做电源,用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为
20、(12分)(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为__ (填序号)。
A.9 B.13 C.11-13之间 D.9-11之间
(2) pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中
c(Na+)_______c(CH3COO-) ( 填“>”、“=”或“<”)。
(3) 如果将HCl和CH3COONa 溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为 。
(4) 常温下,若NaOH溶液中的c(OH―)与CH3COOH 溶液中的c(H+)相同,现将NaOH和CH3COOH的溶液分别稀释10倍,稀释后NaOH 和 CH3COOH溶液的pH分别用pH1和pH2表示。则pH1+pH2 14( “>”、“=”或“<”)
(5)溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)______c(NH3·H2O)(填大于小于或等于,下同),混合前酸中c(H+)和碱中c(OH-)的关系c(H+)_____c(OH-).
19、(10分)(1)Cu(NO3)2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
18、(16分)(1)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断
①蓄电池的负极电极反应式为__ ____。②蓄电池工作时,其中正极附近溶液的pH______(增大、减小、不变)。③实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl20.050mol,这时电池内消耗的H2SO4的物质的量至少是 。
(2)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O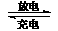 Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
①该电池充电时阳极反应式:
②放电时负极附近溶液的碱性 (填“增强”或“减弱”或“不变”)
(3) Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
①该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
②若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。
 ③MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
。若电解电路中通过2mol电子,MnO2的理论产量为
g。
③MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
。若电解电路中通过2mol电子,MnO2的理论产量为
g。
17.(10分)(1)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+)> c (CN-),用“>、<、=”符号填空
①溶液中c (OH -) c (H +) ②c (HCN) c (CN-)
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:(A)逐渐减小;(B)逐渐增大;(C)先逐渐增大,而后减小;(D)先逐渐减小,而后增大. 你的选择是
(3)pH值相同的 ①HCl(aq)、 ②H2SO4(aq)、 ③ CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/L的NaOH(aq)中和,其中消耗NaOH(aq)最多的是 。
③反应开始时,反应速率 。(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(4)某温度下,纯水中c (H+)=2.0×10-7 mol/L,则此时c (OH-) = mol/L。相同条件下,测得① NaHCO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
16. (10分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
 (2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应
负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Fe2+ |
7.0 |
9.0 |
|
Cu2+ |
4.7 |
6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
15. (10分)如图,X和Y均为石墨电极:
(1)若电解液为滴有酚酞的饱和食盐水,
电解反应的离子方程式为:
电解过程中 极(填阴或阳)附近会出现红色;
(2)若电解液为500mL含A溶质的某蓝色溶液,电解一段时间,观察到x电极表面有红色固态物质生成,Y电极有无色气体生成;当溶液中原有溶质完全电解后,取出x电极,洗涤、干燥、称量,电极增重1.6g。
①电解后溶液的pH= ;要使电解后溶液恢复到电解前的状态,需加入一定量的
(填物质的化学式)(假设电解前后溶液的体积不变)。
②请你推测原溶液中所含的酸根离子可能是 ;并设计实验验证你的推测,写出实验的操作步骤、现象和结论
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com