
题目列表(包括答案和解析)
21.(12分)硫酸在国民经济中占有极其重要的地位,下图是工业接触法制硫酸的简单流程图,试回答下列有关问题.
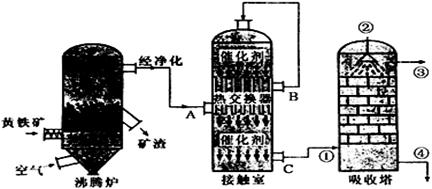
(1)在实际生产过程中,进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是
(2)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室。按此密闭体系中气体的流向,则在B处流出的气体(除N2外)为 ;
(3)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
|
压强/MPa 温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2% |
99.6% |
99.7% |
99.9% |
|
500 |
93.5% |
96.9% |
97.8% |
99.3% |
|
600 |
73.7% |
85.8% |
89.5% |
96.4% |
①已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
②在400-500℃时,SO2的催化氧化采用常压而不是高压,主要原因是: ;
(4)选择适应的催化剂,是否可以提高SO2的转化率? ;是否可以增大该反应所放出的热量? (填“是” 或“否”);
(5)若用浓硫酸吸收SO3可以得到H2SO4·SO3。用1000g 98 % 的H2SO4充分吸收SO3后,再进行稀释,可以得到98% 的硫酸的质量是 。
海南中学2009--2010学年第二学期期终考试
高二化学试题
班级: 姓名: 座号: 分数
第二卷(55分)
20、(10分)我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
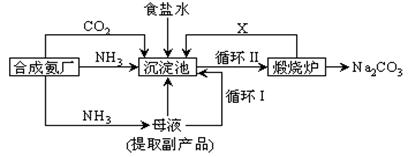
(1) 沉淀池中发生的化学反应方程式是 。
(2) 写出上述流程中X物质的分子式 。
(3) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(4)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(5) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(6) CO2是制碱工业的重要原料,目前,常用的两种制碱方法中CO2的来源有何不同? 。
19、(10分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
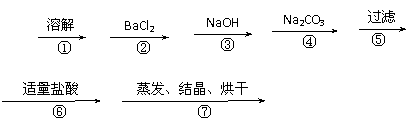
称取粗盐
滤液 精盐
(1)判断BaCl2已过量的方法是_________________________。
 (2)第④步中,相关的离子方程式是___________;
。
(2)第④步中,相关的离子方程式是___________;
。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________。
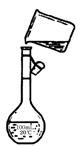
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是__________。
18.(8分)(1)炼钢和炼铁的原理都是利用氧化还原反应,但炼铁的原理是 ,其核心反应是 ,而炼钢的原理主要是 ,
(2)炼铁时常用焦炭形成还原剂,能用煤代替吗? ,为什么? 。
(3)检查钢质设备完好性的方法之一是:在被怀疑有裂纹处涂上10%的盐酸,过一段时间如观察到有粗线裂纹,表明该部分原先确有裂纹,产生粗线裂纹的原因是 。
17.(9分)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是__________________________.
(2)铝与氢氧化钾溶液反应的离子方程式是
.
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.
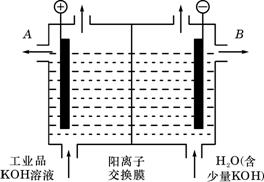 ①该电解槽的阳极反应式是___________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因__________
.
③除去杂质后的氢氧化钾溶液从出口______(填写“A”或“B”)导出。
①该电解槽的阳极反应式是___________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因__________
.
③除去杂质后的氢氧化钾溶液从出口______(填写“A”或“B”)导出。
16.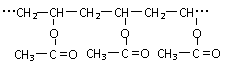 (6分)高分子结构片段为:
(6分)高分子结构片段为:
(1)该高分子化合物属于 (填线型或体型)高分子,其链节是 ,单体的结构简式为 。
(2)若工业要求该化合物的相对分子质量为129000,则单体的重复次数,即聚合度为 。
15.新型无机非金属材料碳化钛(TiC)、碳化硼(B4C)、氮化硅(Si3N4)等为非氧化物陶瓷,合成这些物质需要在高温条件下进行,在合成工艺中必须注意( )。
A.通入充足的氧气 B.避免与氧气接触
C.不能在氮的气氛中合成 D.通入少量氧气
第二卷(55分)
14.合金有许多特点,如Na-K合金为液体,而Na和K的单质均为固体。据此推测:生铁、纯铁、碳三种物质中,熔点最低的是( )
A.纯铁 B.生铁 C.碳 D.无法确定
13.接触法生产H2SO4的过程中,对“三废”处理正确的是( )
①尾气用石灰水处理 ②污水用石灰乳处理 ③废渣用来制水泥、炼铁 ④设置“废热”锅炉产生蒸气、供热或发电
A.只有①② B.只有①③④ C.只有①②③ D.全部
12.关于裂解和裂化的叙述中,不正确的是( )
A.裂解与裂化的产物中都含有不饱和烃
B.裂解与裂化都是为了得到气态烃
C.裂解与裂化的原料都是石油分馏产品
D.裂解与裂化都是使分子量大的烃断裂为分子量小的烃的过程
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com