
题目列表(包括答案和解析)
16.(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。由丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6 kJ·mol-1
CH3CH=CH2(g)= CH4(g)+HC≡CH(g) △H2= +32.4 kJ·mol-1
(1) 相同条件下,反应C3H8(g) =CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通人O2和CO2,负极通人丙烷,电解质是熔融碳酸盐。电池正极的电极反应式为 ;放电时,CO32-移向电池的 (填“正”,或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2,溶于水达到平衡时,溶液的pH=5.6,c(H2CO3)=l.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+ H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
15.(14分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.4 mol/L的醋酸溶液,用0.4 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
⑴配制250 mL 0.4 mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________________和_________________。
⑵为标定该醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
|
实验序号 |
1 |
2 |
3 |
4 |
|
消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为_____________。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
|
醋酸浓度(mol/L) |
0.0010 |
0.0100 |
0.0200 |
0.1000 |
0.2000 |
|
pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
⑶根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
_____________________________________________________________________
_____________________________________________________________________
⑷从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度
____________。(填增大、减小或不变)
实验三 探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案________________________
______________________________________________________________________。
14.用来表示可逆反应:2A(g)+B(g) 2C(g)ΔH<0的正确图象是下图中的( )
2C(g)ΔH<0的正确图象是下图中的( )
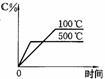
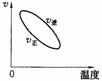
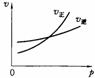
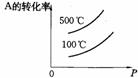
A B C D
第Ⅱ卷(非选择题部分 共72分)
13.在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.由水电离的c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
C.在pH = 1溶液中:NH4+、K+、NO3-、Cl-
D.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
12.高温下,某反应达平衡,平衡常数K=。恒容时,温度升高,H2 浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO + H2 O 催化剂高温 CO2 + H2
11.有一可逆反应 2A(g)+3B(g) xC(g),若按下列两种配比在同温同容积的密闭容器中进行反应:
xC(g),若按下列两种配比在同温同容积的密闭容器中进行反应:
⑴0.8 mol A、1.2 mol B、1.2 mol C ⑵1.4 mol A、2.1 mol B、0.6 mol C
达到平衡后,C的百分含量相等,则该化学方程式中x的值可能为
A.2 B.3 C.4 D.5
10.下列事实不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅。
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅。
B.对CO(g)+NO2(g)  CO2(g)+NO(g),平衡体系增大压强可使颜色变深。
CO2(g)+NO(g),平衡体系增大压强可使颜色变深。
C.升高温度能够促进水的电离。
D.工业上合成NH3的反应,为提高NH3的产率,理论上应采取相对较低温度的措施。
9.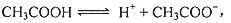 醋酸溶液中存在电离平衡:
下列叙述不正确的是
醋酸溶液中存在电离平衡:
下列叙述不正确的是
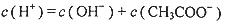 A.CH3COOH溶液中离子浓度的关系满足:
A.CH3COOH溶液中离子浓度的关系满足:
B.0.1 mol / L 的CH3COOH 溶液加水稀释,溶液中c(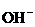 )减小
)减小
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后,溶液
的pH<7
8.工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)
= Si(s)+4HCl(g) 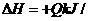 mol(Q>0)
mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只有一个选项,多选时则为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,若选错一个,该小题就为0分)
7.下列说法正确的是
A.常温下若强酸、强碱等体积中和后pH=7,则中和之前pH酸+pH碱=14
B.为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH
C.测定溶液的pH时,应先将pH试纸润湿,然后进行检测
D.在pH=12的溶液中,水电离出的c(OH-)=10-2mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com