
题目列表(包括答案和解析)
1.若要检验酒精中是否含有少量水,可选用的试剂是( )。
A.生石灰 B.金属钠 C.浓硫酸 D.无水硫酸铜
答案:D
27、以石墨为电极,电解1L硫酸铜和氯化钠的混合溶液,其中硫酸铜与氯化钠的物质的量之和为0.2mol,硫酸铜的物质的量分数为x。
(1)若x=0.5,当Cu2+在阴极恰好全部析出时,产生的气体成分和物质的量为
所得溶液的pH= 。(电解前后溶液的体积不变,且不考虑产生的气体的溶解)
(2)电解一段时间后,阴极和阳极产生的气体的物质的量恰好相等,均为0.12mol,试求此时x的值为 。
2010-2011学年度下学期“9+4”联合体期中联考
26、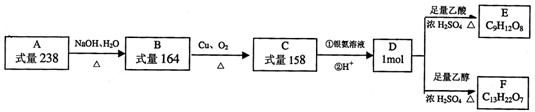 A、B、C、D、E、F都是链状有机物,它们的转化关系如图所示。A中只含有一种官能团,D中含有两种官能团,D分子中不含甲基,且与碳原子相连的氢原子被氯原子取代所得的一氯代物只有1种。请回答下列问题。
A、B、C、D、E、F都是链状有机物,它们的转化关系如图所示。A中只含有一种官能团,D中含有两种官能团,D分子中不含甲基,且与碳原子相连的氢原子被氯原子取代所得的一氯代物只有1种。请回答下列问题。
(1)D中含有官能团是 ,D的分子式 。
(2)写出F的结构简式 ,A的结构简式 。
(3)写出D生成E的化学方程式 。
(4)写出C与银氨溶液反应的化学方程式 。
25、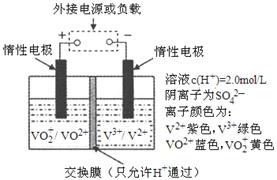 钒(V)及其化合物广泛应用于工业催化、
钒(V)及其化合物广泛应用于工业催化、
新材料和新能源等领域。
(1)全钒液流储能电池是利用不同价态
离子对的氧化还原反应来实现化学
能和电能相互转化的装置,其原理
如右图所示。
①若左槽溶液颜色逐渐由蓝变黄,
其电极反应式为
。
②放电过程中,右槽溶液颜色逐渐由 色变为 色。
③放电过程中氢离子的作用是:通过交换膜定向移动使电流通过溶液形成闭合回路和 ;
④若充电时,左槽溶液中n(H+)的变化量为2mol,则反应转移的电子数为 。
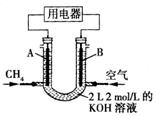 (2)将CH4设计成燃料电池,其利用率更高,装置如图所示
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示
(A、B为多孔碳棒)。持续通入甲烷,在标准状况下,
消耗甲烷的体积为V L。
①0<V≤44.8L时,电池总反应方程式为 ;
②44.8L<V≤89.6L时,负极电极反应为 ;
③V=67.2L时,溶液中离子浓度大小关系为 。
24、对金属制品进行抗腐蚀处理,可延长其使用寿命。
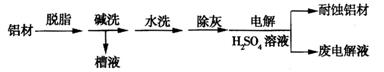 (1)以下为铝材表面处理的一种方法:
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是
(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a. NH3 b. CO2 c. NaOH d. HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为 。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是(用化学方程式表示)
 。
。
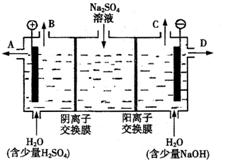
(2)芒硝化学式Na2SO4·10H2O,无色晶体,易
溶于水,是一种分布很广泛的硫酸盐矿物。
该小组同学设想,如果模拟工业上离子交换
膜法制烧碱的方法,用如图2所示装置电解
硫酸钠溶液来制取氢气、氧气、硫酸和氢氧
化钠,无论从节省能源还是从提高原料的利
用率而言都更加符合绿色化学理念。
①该电解槽的阳极反应式
为 。此时通过阴离子交换膜的离子
数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钠溶液从出口(填写“A”、“B”、“C”或“D”) 导出。
23、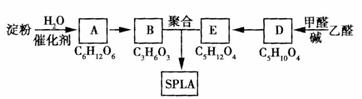 星形聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
星形聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
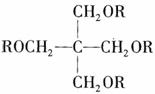
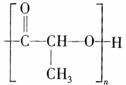
已知:SPLA的结构为 ,其中R为
(1)欲验证淀粉完全水解的产物A,进行如下实验操作:①在试管中加入少量淀粉
②加热3-4min ③加入少量新制的Cu(OH)2 ④加入少量稀硫酸 ⑤加热至沸腾 ⑥待冷却后,滴加NaOH溶液至溶液呈碱性。则以上操作步骤正确的顺序是 (填选项序号)。
a. ①②④⑤③⑥ b. ①④②③⑤⑥
c. ①④②⑥③⑤ d. ①⑤③④⑥②
(2)D结构中有3个相同的基团,且1mol D能与2mol Ag(NH3)2OH反应,则D的结构简式是 ;
(3)B有多种脱水产物,写出其形成聚酯类化合物的化学方程式为 。
(4)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2反应,且1mol G与足量Na反应生成1mol H2,则G的结构简式为 。
22、某化学小组探究液体有机物样品A(C3H8O2)的结构,进行如下实验:
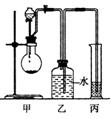 实验Ⅰ: 用如图实验装置,通过Na与A反应确定羟基个数。
实验Ⅰ: 用如图实验装置,通过Na与A反应确定羟基个数。
试回答下列问题:
(1)有机物A从 (填仪器名称)中加入;检验装置甲气密
性的方法是 。
(2)实验前预先将小块钠放在二甲苯中熔化成若干个小球并冷却后
再与有机物A反应,其目的是 。
(3)实验数据记录如下:ρ=1.038g·mL-1
|
实验 编号 |
有机样品 的体积/mL |
有机样品 的质量/g |
生成气体的体积/mL (标准状况下) |
|
Ⅰ |
3.65 |
3.8 |
1120 |
|
Ⅱ |
7.30 |
7.6 |
2240 |
|
Ⅲ |
14.60 |
15.2 |
4000 |
①不能选第 组数据来计算A中羟基个数,这组数据出现错误的原因可能是 (填两条)。
②有机物A中羟基个数为 。
实验Ⅱ: 欲确定有机物A中含氧官能团的位置,进行如下实验:
①取7.30mL A,Cu作催化剂,经氧化后完全转化成液态有机物B。
②取一质量为m1g的洁净试管,向其中加入足量银氨溶液,滴入化合物B,并水浴加热,待充分反应后,静置,小心倒出上层清液,向试管中小心滴加蒸馏水,倒出,再加入蒸馏水,再倒出,最后将试管烘干并称量。重复2次,试管质量均为m2g。
试回答下列问题:
(1)步骤②中小心滴加蒸馏水的目的是 。
(2)若m2-m1=43.2g,则有机物A的结构简式是 。
(3)步骤②中,不宜将银氨溶液换成新制氢氧化铜悬浊液的原因是 。
21、已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ;
(2)Y元素原子的价层电子的轨道表示式为 ;
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和
H2O,该反应的化学方程式是 ;
 (4)比较X的氢化物与同族第二、三周期
(4)比较X的氢化物与同族第二、三周期
元素所形成的氢化物、沸点高低并说
明理由 。
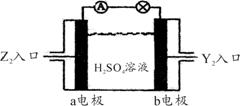
(5)将Y2、Z2按下图所示通入某燃料电池中,
其中b电极的电极反应式为
。
20、已知聚乙炔薄膜是由乙炔加聚得到
(1)聚乙炔的结构简式
(2)一种与聚乙炔具有相同最简式的有机物A、其相对分子质量为52,且分子具有多种同分异构体。
①它的一种链式结构的同分异构体结构简式为CH2=CH-C≡CH,该分子中所有原子是否在同一平面上 ,所有碳原子是否在一条直线上 。(填“是”或“否”)
②它的另一种同分异构体的每个碳原子均达到饱和,空间构型中碳碳键之间夹角都相等,每个碳都直接跟其它三个碳原子相连,则碳碳键之间夹角是 ,它跟Cl2发生取代反应能得到的有机取代产物有
种(填数字)。
(3)另一种有机物芳香烃B跟A最简式相同,相对分子质量是A的两倍,该分子
的结构简式为 。
19、根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
(1)在周期表中,最可能处于同一族的是 。
A、Q和R B、S和T C、T和U D、R和T
E、R和U
(2)下列离子的氧化性最弱的是 。
A、S2+ B、R2+ C、T3+ D、U+
(3)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明 ,如果U元素是短周期的元素,你估计它的第二次电离能飞跃是发生在失去第 个电子时。
(4)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是
,其中元素S的第一电离能异常高的原因是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com