
题目列表(包括答案和解析)
20.(16分)现有部分前四周期7种元素,原子序数依次增大,它们的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
A |
A原子所处的周期数、族序数都与其原子序数相等 |
|
B |
L层s电子数比p电子数少l |
|
C |
核外电子有8种不同的运动状态 |
|
D |
第三周期中的半导体材科 |
|
E |
最外层电子数比次外层电子数少2个电子 |
|
F |
第四周期中未成对电子数最多 |
|
G |
G3+核外电子有3层且M层3d轨道电子半充满 |
(1)B、C、D第一电离由大到小的顺序为(用元素符号表示): 。
 B单质分子中,含有 个
B单质分子中,含有 个 键,
键,
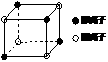
(2)右图是E和G形成的晶体GE2最小单元“晶胞”,
GE2晶体中阴、阳离子数之比为 。
(3)100ml 0.1 mol/L(FCl3·6H2O)水溶液,用过量硝酸银溶液处理,产生0.01 mol AgCl
沉淀。则FCl3·6H2O最可能的化学式是 ______________________
每摩尔D与A形成分子中所含的化学键物质的量为
(4)D单质的熔点 E单质的熔点(填“高于”或“低于”),
其原因是: _____________________________________________________。
(5)G(CO)5在一定条件下发生分解反应:G(CO)5=G(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是 。
18.化学反应可视为旧键断裂和新键生成的过程。键能是形成(拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下键能(kJ· mol-1): P-P:198, P-O:360,O-O:498,则化学反应P4(白磷)+3O2=P4O6 的反应热△H为 ( )
A.-1638 kJ·mol-1 B.+1638 kJ·mol-1 C.-126 kJ·mol-1 D.+126kJ·mol-1

17.关于晶体的下列说法正确的是( )
①在晶体中只要有阴离子就一定有阳离子,只要有阳离子就一定有阴离子;②分子晶体的熔点一定比金属晶体的低;③晶体中分子间作用力越大,分子越稳定;④离子晶体中,一定存在离子键;⑤分子晶体中,一定存在共价键;⑥ 原子晶体中,一定存在共价键;⑦熔融时化学键没有破坏的晶体一定是分子晶体
A.② ④ ⑥ B.④⑤ ⑦ C.④ ⑥ ⑦ D.③ ④ ⑦
16.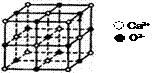 CaO晶胞如右图所示其中Ca2+的配位数为( )
CaO晶胞如右图所示其中Ca2+的配位数为( )
A.4 B. 6 C. 8 D.12
15.已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
X |
578 |
1817 |
2745 |
11578 |
|
Y |
738 |
1451 |
7733 |
10540 |
|
Z |
496 |
4562 |
6912 |
9543 |
则X、Y、Z的电负性从大到小的顺序为( )
A. Z > Y > X B.X > Z > Y C. X > Y > Z D. Y > Z > X
14.下列叙述正确的是( )
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
13.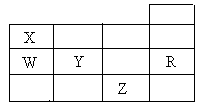 右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.通常情况下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
12.下列说法不正确的是( ) A.NH4NO3、NaOH中既有离子键,又有极性共价键,其中NH4NO3中还有配位键 B.氢键比范德华力强,且氢键是一种特殊的化学键
C.范德华力与氢键可同时存在于分子之间 D.水的沸点是100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7℃,
引起这种差异的主要原因是水分子间有氢键
11.下列分子中的中心原子采取sp2杂化的是 ( )
①C6H6 ②C2H2 ③C2H4 ④C3H8 ⑤CO2 ⑥ BeCl2 ⑦ SO3 ⑧BF3
A.① ② ⑥ ⑦ B. ③ ⑤ ⑦ ⑧ C.① ③ ⑦ ⑧ D.③ ⑤ ⑥ ⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com