
题目列表(包括答案和解析)
8.( )下列判断正确的是
A.含有共价键的化合物一定是共价化合物
B.晶体中一定存在化学键
C.含有离子键的化合物一定是离子化合物
D.金属键越强,金属越活泼,金属熔点越高
7.( )短周期金属元素甲-戊在元素周期表中的相对位置如右表所示:
|
甲 |
乙 |
|
|
丙 |
丁 |
戊 |
下列判断正确的是
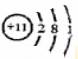
A.原子半径:丙<丁<戊 B. 第一电离能:甲>丙
C.电负性:丙>丁>戊 D. 最外层电子数:甲>乙
6.( ) 下列判断错误的是
A.沸点:NH3>PH3>AsH3 B. 碱性:NaOH>Mg(OH)2>Al(OH)3
C.酸性:HClO4>H2SO4>H3PO4 D. 熔点:SiC>NaCl>SiCl4
5.( ) 下列有关物质结构的表述正确的是
 A. 次氯酸的电子式
A. 次氯酸的电子式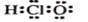 B. 二氧化硅的分子式SiO2
B. 二氧化硅的分子式SiO2
C. 硫原子的最外层电子排布式为3s23p4 D.钠离子的结构示意图为
4.( )下列化合物分子中的所有原子都处于同一直线的是
A.C2H2 B.C2H4 C.PCl3 D.BF3
3.( )某元素质量数52,中子数28,其基态原子未成对电子数为
A.3 B.4 C.5 D.6
2.( )下列晶体熔化时不需破坏化学键的是
A、晶体硅 B、晶体硫 C、食盐 D、金属钾
1.( )下列晶体中,不属于原子晶体的是
A、金刚石 B、水晶 C、晶体硅 D、冰
27.(7分)常温下,向20mL硫酸和盐酸混合溶液中加入0.05mol/L的Ba(OH)2
溶液时,生成BaSO4沉淀量及溶液pH发生如下图所示的变化。
⑴ 开始时混合溶液中硫酸和盐酸的物质的量浓度各是多少?
⑵
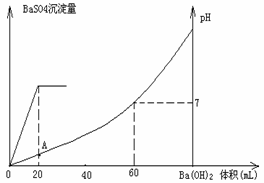 在A点溶液的pH是多少?
在A点溶液的pH是多少?
26.(6分)pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加_________mL;
(2)如果加入pH=10的NaOH溶液,应加_________mL;
(3)如果加0.01mol/L HCl,应加_________mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com