
题目列表(包括答案和解析)
2.
0.04摩KMnO4固体,加热一段时间后,收集到a摩气体,在反应后的留固体中加入足量的浓盐酸,又收集到b摩气体,设此时Mn元素全部以Mn2+存在于溶液中,则:
(1)a+b的取值范围为[答:0.08≤a+b<0.1]
(2)计算若a+b=0.09摩时,残留固体的质量为多少克?[答:6克]
[提示]:2KMnO4
=K2MnO4+MnO2+O2
2a摩 a摩 a摩 a摩
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O
0.04-2a  K2MnO4+8HCl=2KCl+2MnCl2+2Cl2+4H2O
a 2a
MnO2+4HCl=MnCl2+Cl2+2H2O
a a
可知:b=2a+a+
K2MnO4+8HCl=2KCl+2MnCl2+2Cl2+4H2O
a 2a
MnO2+4HCl=MnCl2+Cl2+2H2O
a a
可知:b=2a+a+ =(0.1-2a)
因为a+b=a+(0.1-2a)=0.09,解得a=0.01摩
则O2质量为0.01×32=0.32克,残留固体质量为0.04×158-0.32=6克。
=(0.1-2a)
因为a+b=a+(0.1-2a)=0.09,解得a=0.01摩
则O2质量为0.01×32=0.32克,残留固体质量为0.04×158-0.32=6克。
1.
为了测定血液中钙离子的含量,取5毫升血液样品,稀释成50毫升,从中取出10毫升,加入过量草酸钾(K2C2O4)溶液,使钙离子完全转化成草酸钙沉淀。滤出并洗净所得草酸钙沉淀,用过量稀硫酸溶解,生成草酸和硫酸钙稀溶液。往溶液中加入10毫升0.0020mol/L的KMnO4溶液,使草酸完全被氧化,再用FeSO4溶液滴定过量的KMnO4溶液,当KMnO4溶液的紫红色刚好褪去时,耗0.10mol/L的FeSO4溶液8.9毫升。已知KMnO4溶液和草酸、FeSO4溶液的反应可表示为(未配平):
MnO +H2C2O4+H+®CO2+Mn2++H2O
MnO
+H2C2O4+H+®CO2+Mn2++H2O
MnO +Fe2++H+®Fe3++Mn2++H2O
求血样中钙离子的含量(以100毫升血液中含钙离子多少克表示)。
[解]:将有关反应式配平:
2MnO
+Fe2++H+®Fe3++Mn2++H2O
求血样中钙离子的含量(以100毫升血液中含钙离子多少克表示)。
[解]:将有关反应式配平:
2MnO +2H2C2O4+6H+®10CO2+2Mn2++8H2O
MnO
+2H2C2O4+6H+®10CO2+2Mn2++8H2O
MnO +5Fe2++8H+®5Fe3++Mn2++4H2O
得反应关系式为:Ca2+-CaC2O4-H2C2O4
跟H2C2O4反应的KMnO4的量=0.0020×10×10-3-0.010×8.9×10-3×
+5Fe2++8H+®5Fe3++Mn2++4H2O
得反应关系式为:Ca2+-CaC2O4-H2C2O4
跟H2C2O4反应的KMnO4的量=0.0020×10×10-3-0.010×8.9×10-3× =2.2×10-6(摩)
H2C2O4的量=2.2×10-6×
=2.2×10-6(摩)
H2C2O4的量=2.2×10-6× =5.5×10-6(摩)
100毫升血样中的钙离子质量=5.5×10-5×40×
=5.5×10-6(摩)
100毫升血样中的钙离子质量=5.5×10-5×40× ×
× =0.022克
=0.022克
15.
计 算 题
14.
 燃烧时除了生成水以外,还可生成少量的
燃烧时除了生成水以外,还可生成少量的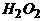 ,但一般条件下很得到
,但一般条件下很得到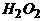 。如果将
。如果将 燃烧时产生的火焰用冰块冷却,就可检验出有极少量的
燃烧时产生的火焰用冰块冷却,就可检验出有极少量的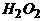 生成。实验前,用两只蒸发皿盛好冰(用蒸馏水冷凝而成),做对比实验如下:
I、一只蒸发皿放在石棉网上加热,使冰块慢慢熔化成液体,再加入0.1mol/LKI-淀粉溶液,不显蓝色。
II、另一只蒸发皿用调节好的氢气火焰对着冰块加热,熔化成液体后,再加入0.1mol/LKI-淀粉溶液,立即成蓝色。
试回答:
(1)为什么一般条件下得不到
生成。实验前,用两只蒸发皿盛好冰(用蒸馏水冷凝而成),做对比实验如下:
I、一只蒸发皿放在石棉网上加热,使冰块慢慢熔化成液体,再加入0.1mol/LKI-淀粉溶液,不显蓝色。
II、另一只蒸发皿用调节好的氢气火焰对着冰块加热,熔化成液体后,再加入0.1mol/LKI-淀粉溶液,立即成蓝色。
试回答:
(1)为什么一般条件下得不到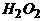 ?
[答:
?
[答: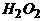 不稳定,遇热易分解]
(2)为什么要做对比实验I?
[答:排除冰块熔化后所得的液体也能使KI-淀粉溶液变蓝的可能]
(3)为了增强实验效果,且能迅速检出反应过程中生成的
不稳定,遇热易分解]
(2)为什么要做对比实验I?
[答:排除冰块熔化后所得的液体也能使KI-淀粉溶液变蓝的可能]
(3)为了增强实验效果,且能迅速检出反应过程中生成的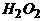 ,在不另加任何试剂和用品的情况下,你认为如何改进为好?
[答:在蒸发皿中先加入KI-淀粉溶液,用氢氧焰直接对着冰块加热]
(4)可否将实验II中的淀粉换成酚酞试液?为什么?
[答:不可以,因为在中性环境中,
,在不另加任何试剂和用品的情况下,你认为如何改进为好?
[答:在蒸发皿中先加入KI-淀粉溶液,用氢氧焰直接对着冰块加热]
(4)可否将实验II中的淀粉换成酚酞试液?为什么?
[答:不可以,因为在中性环境中,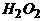 不可能生成
不可能生成 ]
]
13.
1971年,斯图杰尔和阿佩里曼成功地合成了次氟酸。他们是在0℃以下将氟从细冰末上面通过,得到毫克量的次氟酸。已知次氟酸的分子组成与次氯酸类似,分子中原子间亦以共价键结合。
(1)写出次氟酸的结构式[答:H-O-F]
(2)写出上述制取次氟酸的化学方程式[答:F2+H2O=HFO+HF]
(3)次氟酸根很不稳定,试预测其受热分解的可能途征,用化学方程式表示[答:2HFO=2HF+O2]
(4)次氟酸在刹那间能完成与热水的反应,此时得到的溶液,既表现氧化性(对于I-),又表现有还原性(对于MnO ),可推测次氟酸与热水反应的产物中含有[答:H2O2]
),可推测次氟酸与热水反应的产物中含有[答:H2O2]
12. 在亚硝酸钠(NaNO2)中氮元素的化合价为+3价,为证明和研究亚硝酸钠的性质,现有以下几种试剂可供选择: ①KMnO4溶液 ②稀H2SO4溶液 ③稀HNO3溶液 ④稀NaOH溶液 ⑤淀粉、KI溶液 ⑥品红溶液 试用上述试剂回答下列各问: (1)证明NaNO2具有氧化性应选择的试剂是 ,发生反应的离子方程式是 。 (2)证明NaNO2具有还原性应选择的试剂是 ,发生反应的离子方程式是 。 (3)在NaNO2溶液中加入稀硫酸时,溶液呈现浅蓝色,这说明生成的新物质是 ,表示这一反应的化学方程式是 。 [提示]:(3)生成的新物质是N2O3,弄清这一点是解题的关键所在!
11. 用氯酸钾加热分解法制得的氧气常含有微量的氯气和臭氧。为测定氯气和臭氧的含量,将氯酸钾受热分解后所得气体V1升通过足量的KI溶液,所得气体干燥后体积为V2升(标准状况)。再用Na2S2O3溶液逐滴滴定测KI溶液中的I2,反应如下: O3+2KI+H2O=O2+I2+2HOH Cl2+2KI=I2+2KCl I2+2Na2S2O3=2NaI+Na2S4O6 若V1=1.00升,V2=0.98升,滴定时消耗0.10mol/L的Na2S2O3溶液0.0267升,求氯酸钾受热分解得到的气体里Cl2和O3的体积分数。 [提示]:氯气=0.0008928摩尔,臭氧=0.0004421摩尔
10.
在水溶液中N2H 将Fe3+还原为Fe2+:N2H
将Fe3+还原为Fe2+:N2H +4Fe3+®4Fe2++Y+…,则Y可能是 。该反应的离子方程式为
。
[提示]:N2、N2H
+4Fe3+®4Fe2++Y+…,则Y可能是 。该反应的离子方程式为
。
[提示]:N2、N2H +4Fe3+®4Fe2++N2+5H+
+4Fe3+®4Fe2++N2+5H+
9. 有一种稀有气体化合物六铂氟酸氙XePtF6,研究报告指出:“关于XePtF6的电价有Xe2+[PtF6]2-、Xe+[PtF6]-两种可能,巴特列用不可能参加氧化还原反应的五氟化碘作溶剂,将XePtF6溶解,然后在此溶液中加入RbF可得到RbPtF6;加入CsF可得到CsPtF6,这些化合物都不溶于CCl4等非极性溶剂。”试回答: (1)XePtF6中各元素的化合价分别是 、 、 。 (2)XePtF6是 (离子、共价)化合物。 (3)写出Xe与PtF6反应生成XePtF6的反应式 。而且O2与PtF6可发生类似反应,其反应式是 ,上述两反应属( ) A、均为氧化还原反应 B、均为非氧化还原反应 C、前者是氧化还原反应,后者是非氧化还原反应 [提示]:(1)+1、+5、-1 (2)离子 (3)Xe+PtF6=XePtF6 O2+PtF6=O2PtF6 A
7.已知氧化性Cl2>Br2>Fe3+。往500毫升2.0摩/升的FeBr2溶液中通入a摩氯气,试确定a不同取值范围时的氧化产物及其对应的物质的量,填入下表:
|
a值的范围 |
氧化产物及其物质的量 |
0<a£ |
[答:FeBr3= 摩,FeCl3= 摩,FeCl3= 摩(或Fe3+=2a摩)] 摩(或Fe3+=2a摩)] |
 <a£ <a£ |
[答:FeBr3= 摩,Br2= 摩,Br2= 摩,FeCl3= 摩,FeCl3= 摩(或 Fe3+=1摩, Br2= 摩(或 Fe3+=1摩, Br2= 摩)] 摩)] |
a³ |
[答:FeCl3=1摩, Br2=1摩] |
[提示]:当 <a£
<a£ 时,可采用直接配平法:
FeBr2+aCl2
=
时,可采用直接配平法:
FeBr2+aCl2
=  FeBr3+
FeBr3+ Br2+
Br2+ FeCl3
FeCl3
8.配平下列氧化-还原反应 (1)[2]KMnO4+[5]SO2+[2]H2O == [2]MnSO4+[1]K2SO4+[2]H2SO4
(2)[6]KI+[2]K2CrO4+[6]HCl == [2]CrCl3+[10]KCl+[3]I2+[8]H2O (3)[1]K2Cr2O7+[6]Fe3O4+[31]H2SO4 == [1]Cr2(SO4)3+[9]Fe2(SO4)3+[1]K2SO4+[31]H2O (4)[1]As2S3+[10]HNO3 == [2]H3AsO4+[3]S+[10]NO2+[2]H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com