
题目列表(包括答案和解析)
4. 等质量的Na2CO3、NaHCO3与足量盐酸作用,符合下列情况的是
A. Na2CO3比NaHCO3反应速率快 B. 相同条件下Na2CO3产生的CO2体积大
C. NaHCO3比Na2CO3反应剧烈 D. 两者放出CO2的体积一样
3. 将a g金属钠投入到b g水中(水过量),反应后所得溶液的质量分数是
A. a/(a+b) ´100% B. 40a/ (a+b) ´100% C. 20a/(a+b) ´ 100% D. 40a/(22a+23b) ´ 100%
2.金属钠在空气中长久放置,最终生成物是
A. Na2O2 B. Na2O C. Na2CO3 D. NaOH
1.(05江苏9.)下列有关钠的叙述中,错误的是
A . 钠的还原性很强,可以用来冶炼金属钛、锆、铌等
B. 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C. 钠是一种灰黑色的固体
D. 钠的质地软,可用小刀切割
25.(10分)用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液500mL,每次实验均充分反应。实验记录如下:
|
实验次数 |
样品质量/g |
沉淀质量/g |
|
1 |
1.716 |
2.758 |
|
2 |
2.574 |
|
|
3 |
3.432 |
5.516 |
|
4 |
4.290 |
5.516 |
回答下列问题:
(1)第2次实验中产生沉淀质量是多少,将结果填入表格空白处。
(2)Ba(OH)2溶液中溶质的物质的量浓度是 。
(3)第2次实验样品中NaHCO3的物质的量是 。
(4)室温下取第2组实验所得溶液体积的1/10,加水配成500mL溶液,求稀释以后溶液的PH?
24.(8分)一包重41.6 g的固体样品,其成分是硫和铁的化合物,将它充分煅烧后,硫和铁分别被氧化成SO2和Fe2O3,其中SO2在标准状况下为13.44 L。试求:
(1)样品中硫元素与铁元素的物质的量之比。
(2)样品化合物的成分是什么?
(3)样品中化合物的物质的量各为多少?
23.(10分)《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%。阴离子中SO42-和NO3-的质量比约为4.13:1, NO3-的比例呈明显上升的趋势。
回答下列问题:
⑴江苏省大气污染特征是( )
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
⑵请你提出江苏省防治酸雨的两条主要措施_____________________________________ __
⑶某校研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①如果你参加该课题的探究,在小组讨论测定地点时,你建议选择的测定地点分别是_____________________________________________________________________
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是____________________________。
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
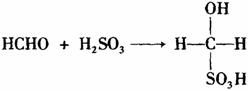
该反应类型属于_______________。测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量;实验测得SO2含量与溶液的吸光度A的关系如下图所示。
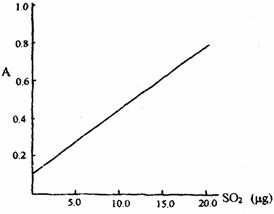
若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为__________________________________________________________
22.(10分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。

请回答:
(1)W的电子式是 。
(2)X与Y在溶液中反应的离子方程式是 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
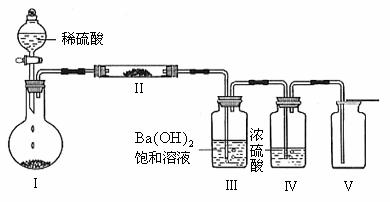
①装置Ⅱ中物质的化学式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 (从上图中选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 。
21.(8分)中学化学中几种常见物质的转化关系如下:
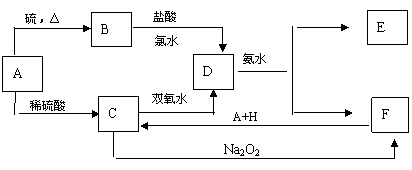
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)A在周期表中的位置_______________B、H的化学式:B ,H 。
(2)①H2O2分子的结构式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(3)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子
方程式: 。
20.(10分)氯气泄漏事件在国内外时有发生,常给国家和人民生命财产造成不少损失。如果发生了氯气泄露事件,切忌惊慌,应向上风向地区转移,并用湿毛巾护住口鼻;到了安全地带要好好休息,避免剧烈运动,以免加重心肺负担。氯气是很重要的工业原料,很多化学物质成分中均含有氯,如饮用水消毒常用的消毒剂;三氯化磷是无色液体,是重要的化工原料,可用来制造许多磷的化合物,如敌百虫等多种农药。
科学家舍勒在化学上的另一个重要的贡献是发现了氯气。一般情况下,在实验室中常用较强的氧化剂如MnO2、PbO2、KMnO4、KClO3、Ca(ClO)2等氧化盐酸制氯气。
⑴写出用PbO2和浓盐酸反应制备氯气时的化学方程式:_____________________,已知PbO2是一种两性氧化物,试写出PbO2和NaOH浓溶液反应时的离子方程式________________
(2)磷在氯气中燃烧可生成无色液体PCl3和淡黄色晶体PCl5,PCl3还可继续与Cl2作用生成PCl5,PCl3和PCl5均可与水反应:PCl3+3H2O=H3PO3+3HCl, PCl5+H2O=POCl3+2HCl,PCl5+4H2O=H3PO4+5HCl。PCl5 PCl3+Cl2↑。
PCl3+Cl2↑。
①已知PCl3分子为三角锥形结构,键角为100°,H3PO3与足量NaOH溶液作用的产物是Na2HPO3,则在下列物质的分子中各原子的最外层均达到了八个电子结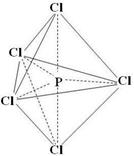 构的是___________(填序号)。
构的是___________(填序号)。
A.PCl3 B.PCl5 C.Na2HPO3 D.Na3PO4
②已知PCl5分子为三角双锥形结构的非极性分子(如图所示),
则PCl3F2有_____种同分异构体。
③水在液态时存在H3O+和OH-,液氨中存在少许NH4+和NH2-,PCl5在一定条件下也存在类似水和氨的解离方式,其中一种离子呈四面体结构,则解离的两种离子分别是____________和___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com